题目内容
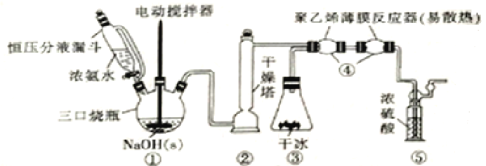
【题目】H2NCOONH4(59℃时升华并分解)可用作磷化铝中间体及医药等。可由干燥的NH3与CO2在低温下(或冰水浴)制取,装置如图所示:
回答下列问题:
(1)装置①中用“恒压分液漏斗”代替普通的分液漏斗,其优点是_____________,滴入浓氨水并搅拌能产生大量NH3的原因是____________________,装置②干燥塔中盛放的合适干燥剂是_____________(填名称)。
(2)装置③用盛干冰装置代替实验室制备CO2的常见制备及纯化转置,其优点除装置简洁且可产生纯净干燥的CO2外,还具有的优点是____________________________________。
(3)装置④用“聚乙烯薄膜反应器”代替反应管的优点是____________,“聚乙烯薄膜反应器”中发生反应的化学方程式为_____________________________________________。
(4)从环境保护角度分析,装置⑤的作用是_____________,还可以通过观察气泡确定NH3和CO2的比例是否合适,判断的依据及不合适时的调节方案为________________。
【答案】便于液体顺利滴入三口烧瓶中 NH3(g)+H2O(1)![]() NH3·H2O(aq)
NH3·H2O(aq)![]() NH4+(aq)+OH-(aq),增大了OH-浓度使平衡逆向移动,且NaOH固体可以吸水,减少了游离水的量并放出了热量,这都有利于NH3逸出 碱石灰 干冰升华吸热,可维持反应在低温下进行 可轻轻揉搓得到粉末状的H2NCOONH4(或易散热,有利于提高H2NCOONH4的转化率并避免分解) 2NH3+CO2=H2NCOONH4 吸收未反应完的NH3 若无气泡产生,说明比例合适,若有气泡产生,可以通过调节恒压滴液漏斗的活塞控制浓氨水的加入速率
NH4+(aq)+OH-(aq),增大了OH-浓度使平衡逆向移动,且NaOH固体可以吸水,减少了游离水的量并放出了热量,这都有利于NH3逸出 碱石灰 干冰升华吸热,可维持反应在低温下进行 可轻轻揉搓得到粉末状的H2NCOONH4(或易散热,有利于提高H2NCOONH4的转化率并避免分解) 2NH3+CO2=H2NCOONH4 吸收未反应完的NH3 若无气泡产生,说明比例合适,若有气泡产生,可以通过调节恒压滴液漏斗的活塞控制浓氨水的加入速率
【解析】
装置①由浓氨水分解制NH3,经过②干燥,与③中干冰升华产生的CO2一起进入④中反应,得到产物H2NCOONH4,装置⑤中的浓H2SO4可以吸收多余的NH3。
(1)装置①中的“恒压分液漏斗”侧面有一根玻璃管连通上下,可以平衡漏斗中液体上下的气压,便于液体顺利滴入三口烧瓶中;浓氨水中存在反应NH3(g)+H2O(1)![]() NH3·H2O(aq)
NH3·H2O(aq)![]() NH4+(aq)+OH-(aq),NaOH遇水产生大量的热,并且有大量OH-,促使平衡向生成NH3的方向移动,从而产生大量NH3;NH3一般用碱石灰进行干燥;
NH4+(aq)+OH-(aq),NaOH遇水产生大量的热,并且有大量OH-,促使平衡向生成NH3的方向移动,从而产生大量NH3;NH3一般用碱石灰进行干燥;
(2)NH3与CO2在低温下反应制取,干冰升华吸热,可以维持低温环境;
(3)“聚乙烯薄膜反应器”比较柔软,可以隔着反应器揉搓得到粉末状的H2NCOONH4,而且薄膜容易散热,有利于提高H2NCOONH4的转化率并避免分解;反应的化学方程式为2NH3+CO2=H2NCOONH4;
(4)由于NH3有污染,浓H2SO4可以吸收多余的NH3;浓H2SO4可以吸收多余的NH3,但不会吸收CO2,若NH3与CO2比例刚好能完全反应,则不会有CO2剩余,那么浓H2SO4中就不会看到气泡,若能看到气泡,则说明CO2产生的较快,需要加快NH3的速率。

【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。