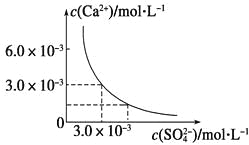
��Ŀ����
����Ŀ������۲�����װ�ã��ش��������⣺

(1)װ��B��PbO2�Ϸ����ĵ缫��Ӧ����ʽΪ___��������K+����___(����װ��B������װ��C��)��
(2)װ��A���ܷ�Ӧ�����ӷ���ʽΪ___��
(3)��װ��E�е�Ŀ������Cu�����϶�������XΪ___������N�IJ���Ϊ___��
(4)װ��D���Ҳ�ʯī�缫��ӦʽΪ��___��
(5)ij������������Һʵ�ַ��硢������λһ���ϵ�װ��ʾ��ͼ��ͼ��ʾ������װ�ù���ʱ����Ҫ����գ�
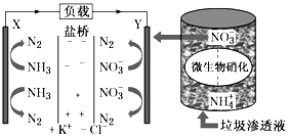
�ٵ����ɼ�___(����X��Y������Y��X��)������·������7.5mol����ʱ����������״����N2�����Ϊ___��
��Y�������ķ�ӦΪ��___��
���𰸡�PbO2+2e-+4H++SO42- =PbSO4+2H2O װ��B Cu+2H+![]() Cu2++H2�� AgNO3 Ag 2Cl--2e-=Cl2�� Y��X 44.8L 2NO
Cu2++H2�� AgNO3 Ag 2Cl--2e-=Cl2�� Y��X 44.8L 2NO![]() +10e-+6H2O=N2��+12OH-
+10e-+6H2O=N2��+12OH-
��������
��ͼʾ��֪��B��C���������ӣ����B��Cװ���е������Һ�͵缫��B��C����Ǧ���أ�����ԭ���װ�ã�Ǧ��������ΪPbO2������ΪPb����A��D��EΪ���أ����ص�������ԭ��ص����������������븺����������װ��A�У�Pt�缫Ϊ������Cu�缫Ϊ������װ��D�У���˵�ʯī�缫Ϊ�������Ҷ˵�ʯī�缫Ϊ������װ��E��M�缫Ϊ������N�缫Ϊ�������ݴ˷������(1)~(4)��
(5)���ݴ�����������Һ�����䷢���ʾ��ͼ֪����װ������ԭ���װ�ã�X�Ǹ�������������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2NH3-6e-+6OH-�TN2+6H2O��Y��������NO3-�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3-+10e-+6H2O�TN2��+12OH-�������������������������������������������������������ݴ˻ش�
(1)���ݷ�����B��C����Ǧ���أ�����ԭ���װ�ã�Ǧ��������ΪPbO2���缫��Ӧ����ʽΪPbO2+2e-+4H++SO42-=PbSO4+2H2O��ԭ������������������ƶ�����������K+����PbO2�缫���ڵ�װ���ƶ�����װ��B�ƶ���
(2)���ݷ�����װ��AΪ���أ�װ��A�У�Cu�缫Ϊ�������缫��ӦΪ��Cu-2e-=Cu2+��Pt�缫Ϊ���������ݷŵ�˳���������������ŵ磬�缫��ӦΪ��2H++2e-=H2������װ��A���ܷ�Ӧ�����ӷ���ʽΪCu+2H+![]() Cu2++H2����
Cu2++H2����
(3)���ݷ�����װ��EΪ���أ�����M�缫Ϊ������N�缫Ϊ��������װ��E�е�Ŀ������Cu�����϶���������Ϊ�Ʋ������CuΪ�Ƽ�����Ƴ��жƲ�������������Ƽ������������ҺҪ���жƲ�������ӣ���XΪAgNO3������N�IJ���ΪAg��
(4)���ݷ�����װ��DΪ���أ������Ҷ˵�ʯī�缫Ϊ�������������ҺΪ�Ȼ�����Һ�������������ӷŵ磬���ݷŵ�˳���������������Ϸŵ磬�缫��ӦʽΪ��2Cl--2e-=Cl2����
(5)�ٸ��ݷ�����֪��װ������ԭ���װ�ã�X�Ǹ�����Y��������������������������������Y��X��X�Ǹ�������������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��2NH36e+6OH�TN2+6H2O��Y��������NO3�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3+10e+6H2O�TN2��+12OH�����ܷ�ӦʽΪ��5NH3+3NO3�T4N2+6H2O+3OH�����ݵ���ܷ�Ӧ��֪������4mol N2ʱ��·��ת��15mol���ӣ���·������7.5mol����ʱ����������״����N2�����Ϊ![]() ��4mol��22.4L/mol=44.8L��
��4mol��22.4L/mol=44.8L��
�ڸ��ݷ�����Y��������NO3-�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪ��2NO3-+10e-+6H2O�TN2��+12OH-��