题目内容
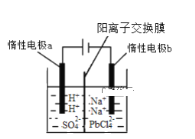
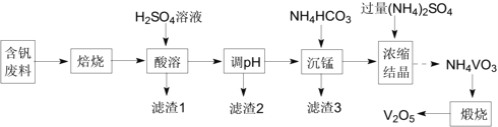
【题目】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物![]() 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__![]() 写出2种即可
写出2种即可![]() ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
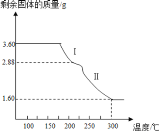
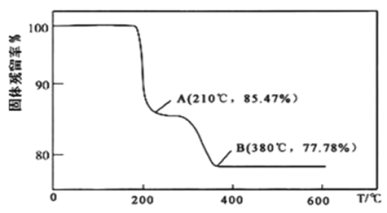
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率(![]() ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色![]() 被还原为VO2+蓝色
被还原为VO2+蓝色![]() ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。
【答案】除去有机物杂质,将V2O3氧化为V2O5 制光导纤维、制玻璃、制硅胶等 是 温度过低,反应速率慢,NH4VO3可能提前结晶析出导致产率低,温度过高,NH4HCO3分解,导致原料利用率低 取少量最后一次洗涤液于洁净的试管中,滴加BaCl2溶液,无明显现象,证明NH4VO3已洗涤干净 NH3 H2O 2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O 91.00%
【解析】
含钒废料(含V2O3、CuO、 MnO、SiO2、A12O3、有机物)焙烧后,有机物杂质会燃烧除去,将V2O3氧化为V2O5;滤渣1为不与硫酸反应的二氧化硅,剩余含有Cu2+、 Mn2+、Al3+和钒离子,调节pH将杂质离子生成难溶物除去,碳酸氢铵除锰,剩余物质NH4VO3煅烧得到V2O5 ;利用氢氧化铜的溶度积公式计算出铜离子的浓度,与10-5比较,小于10-5 则沉淀完全;“沉锰”时所用试制为NH4HCO3,温度过低时,反应速率较慢,NH4VO3可能提前结晶析出,导致产率较低;温度过高时,NH4HCO3分解使原料的利用率降低,并导致环境污染; NH4VO3晶体可能粘附HCO3- ,SO42-等,故加入氧化钡溶液;由图像上不同温度下的固体残留率,得到失去的物质;根据实验现象写出离子方程式,根据离子方程式计算得出产率。据此分析。
(1)由含钒废料的成分和流程图中物质的转化关系知,“焙烧"的目的是除去有机物杂质,并将V2O3氧化为V2O5,故答案为:除去有机物杂质,将V2O3氧化为V2O5;
(2)“滤渣1”为二氧化硅,可用于制作光导纤维,玻璃,制取硅胶,硅单质等,由流程图中信息知,“调pH”的目的是将Cu2+转化为Cu(OH)2沉淀,调节pH为7时,溶液中c(H+)=10-7mol/L,c(OH-)=![]() mol/L=
mol/L=![]() =10-7mol/L,
=10-7mol/L,
c(Cu2+)=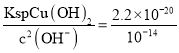 =2.2×10-6<10-5,故沉淀完全,故答案为:制光导纤维、制玻璃、制硅胶等;是;
=2.2×10-6<10-5,故沉淀完全,故答案为:制光导纤维、制玻璃、制硅胶等;是;
(3)“沉锰”时所用试制为NH4HCO3温度过低时,反应速率较慢,NH4VO3可能提前结晶析出,导致产率较低;退度过高时,NH4HCO3分解使原料的利用率降低,并导致环境污染,故答案为:温度过低,反应速率慢,NH4VO3可能提前结晶析出导致产率低,温度过高,NH4HCO3分解,导致原料利用率低;
(4) NH4VO3晶体可能粘附HCO3-,SO42-等,故证明NH4VO3已洗涤干净的实验操作及现象为:取少量最后一次洗涤液于洁净试管中,滴加BaCl2溶液,无明显现象,证明NH4VO3已洗涤干净,故答案为:取少量最后一次洗涤液于洁净试管中,滴加BaCl2溶液,无明显现象,证明NH4VO3已洗涤干净;
(5)NH4VO3分解的过程中生成氨气和HVO3,210℃时若分解生成酸和氨气,假设起始NH4VO3的质量为117g,则剩余固体占起始固体百分含量为![]() ≈85.47%,所以210℃时,剩余固体物质的化学式为HVO3,失去的物质为NH3,380℃时,HVO3进一步分解生成V2O5和水,则剩余固体占起始固体百分含量为
≈85.47%,所以210℃时,剩余固体物质的化学式为HVO3,失去的物质为NH3,380℃时,HVO3进一步分解生成V2O5和水,则剩余固体占起始固体百分含量为![]() =77.78%,故剩余固体是V2O5,失去的物质为H2O,故答案为:NH3;H2O;
=77.78%,故剩余固体是V2O5,失去的物质为H2O,故答案为:NH3;H2O;
(6)已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色(被还原为VO2+蓝色),则离子方程式为![]() ;准确称取产品V2O52.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00mL,已知离子方程式为
;准确称取产品V2O52.0g,加入足量的稀硫酸使其完全生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol/L的H2C2O4溶液滴定,消耗标准液10.00mL,已知离子方程式为![]() 则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,所以250mL溶液中
则n(VO2+)=2n(H2C2O4)=2×0.01L×0.1000mol/L,所以250mL溶液中
n(VO2+)=2×0.01L×0.1000mol/L×![]() =0.02mol,所以n(V2O5)=0.01mol,其质量为
=0.02mol,所以n(V2O5)=0.01mol,其质量为
0.01mol×182g/mol=1.82g,所以产品的纯度为![]() ×100%=91.00%,故答案为:
×100%=91.00%,故答案为:![]() ;91.00%。
;91.00%。

【题目】非金属及其化合物在工农业生产、生活中有着重要应用,减少非金属的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
若某反应的平衡常数表达式为:K=![]() ,请写出此反应的热化学方程式___。
,请写出此反应的热化学方程式___。
(2)N2O5在一定条件下可发生分解:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g) △H>0。向恒容密闭容器加入N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/(mo·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.35 | 0.35 |
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=__;1.00min~3.00min内,O2的平均反应速率为__。从表中可知化学反应速率变化规律是__。
①该温度下反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是__。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2v正(NO2)=v逆(N2O5) d.混合气体的密度保持不变
(3)“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析B极发生的电极反应式为__。