题目内容
【题目】将PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。
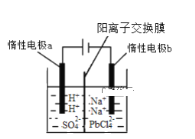
①写出电解时阴极的电极反应式_____________。
②电解过程中通过阳离子交换膜的离子主要为________。
③电解过程中,Na2PbCl4电解液浓度不断减小,为了恢复其浓度,应该向___________极室(填“阴”或者“阳”)加入____________(填化学式)。
【答案】![]() H+ 阴 PbO
H+ 阴 PbO
【解析】
如图电解池装置中,阳极H2O失去电子发生氧化反应生成氧气,阴极PbCl42-得到电子发生还原反应生成Pb,由此回答。
(1)电解时阴极PbCl42-得到电子发生还原反应生成Pb,电极方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)电解时阳极H2O失去电子发生氧化反应:![]() ,为了平衡电荷,生成的H+会通过阳离子交换膜移向阴极,故答案为:H+;
,为了平衡电荷,生成的H+会通过阳离子交换膜移向阴极,故答案为:H+;
(3)电解过程阴极发生反应:![]() ,由于溶液中含有Na+和和通过阳离子交换膜移向阴极的H+,则阴极溶液中含有溶质HCl和NaCl,则可向阴极室添加PbO生成Na2PbCl4电解液,故答案为:阴;PbO。
,由于溶液中含有Na+和和通过阳离子交换膜移向阴极的H+,则阴极溶液中含有溶质HCl和NaCl,则可向阴极室添加PbO生成Na2PbCl4电解液,故答案为:阴;PbO。

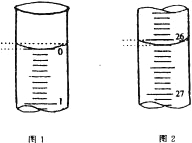
【题目】为探究新制氯水的性质,某学生做了如下实验。
实验 | 装置 | 试剂a | 现象 |
① |
| 紫色的石蕊试液 | 溶液先变红后褪色 |
② | NaHCO3溶液 | 产生气泡 | |
③ | HNO3酸化的AgNO3溶液 | 产生白色沉淀 | |
④ | FeCl2溶液、KSCN溶液 | 溶液变红 |
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是
A.实验①说明新制氯水中含有H+、HClO
B.实验②发生的反应为HCO3-+HClO=ClO-+CO2↑+H2O
C.实验③说明新制氯水中有Cl-,Cl-+Ag+=AgCl↓
D.实验④说明氯气具有强氧化性,Cl2+2Fe2+=2Cl-+2Fe3+
【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
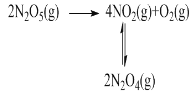
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
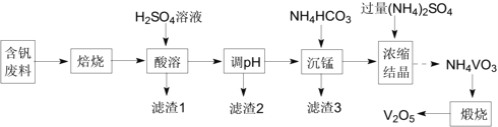
【题目】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物![]() 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__![]() 写出2种即可
写出2种即可![]() ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
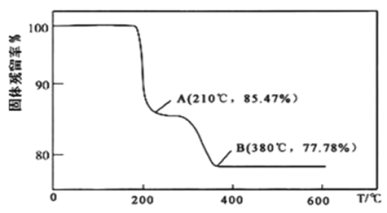
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率(![]() ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。![]() 填写分子式
填写分子式![]()
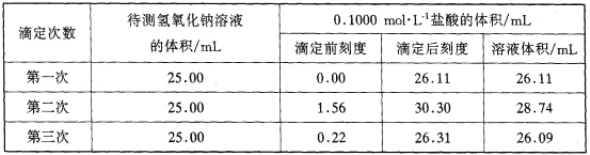
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色![]() 被还原为VO2+蓝色
被还原为VO2+蓝色![]() ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。