题目内容
(2010?石景山区一模)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
③在起始体系中加入N2的物质的量为
mol时,反应后氨的百分含量最大.若容器容积为1L,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K=
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3?4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为
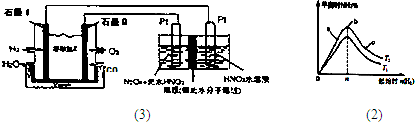
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图1所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
226.3kJ
226.3kJ
;(2)某科研小组研究在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响,实验结果如图2所示:(图中T表示温度,n表示物质的量)
①图象中T1和T2的关系是:T1
<
<
T2(填“>”、“<”、“=”或“无法确定”)②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是
c
c
(填字母标号),③在起始体系中加入N2的物质的量为
| n |
| 3 |
| n |
| 3 |
2.08(mol?L-1)-2
2.08(mol?L-1)-2
;(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注.
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3?4NO2(g)+O2△H>0下表为反应在某温度下的部分实验数据则50s内NO2的平均生成速率为
0.0592mol?L-1?s-1
0.0592mol?L-1?s-1
| V/s | 0 | 50 | 100 |
| c(N2O3)/mol?L-1 | 5.00 | 3.52 | 2.48 |
H2+CO32-═CO2+H2O+2e-
H2+CO32-═CO2+H2O+2e-

分析:(1)根据盖斯定律来求反应的焓变;
(2)①根据温度对化学平衡移动的影响知识来回答;
②根据a、b、c三点所表示的意义来回答;
③根据化学平衡状态是反应物的转化率最大,生成物的产率最大来回答;
(3)根据反应速率v=
来计算;
(4)根据氢氧燃料电池放电的规律和特点来回答.
(2)①根据温度对化学平衡移动的影响知识来回答;
②根据a、b、c三点所表示的意义来回答;
③根据化学平衡状态是反应物的转化率最大,生成物的产率最大来回答;
(3)根据反应速率v=
| △c |
| △t |
(4)根据氢氧燃料电池放电的规律和特点来回答.
解答:解:(1)17g氨气经催化氧化完全生成一氧化氮气体和水蒸气的焓变=
(180.5kJ?mol-1×2+92.4kJ?mol-1×2-483.6×3)=-226.3 kJ?mol-1,故答案为:226.3 kJ;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
③当氮气和氢气的物质的量之比为1:3达平衡状态时,氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为
,当n=3mol反应达到平衡时,H2的转化率为60%,故起始氮气浓度为1mol/l,变化的氢气浓度为1.8mol/l,变化的氮气浓度为0.6mol/l,平衡时氮气、氢气、氨气的浓度分别是0.4mol/l、1.2mol/l、1.2mol/l,据k=
=
=2.08 (mol?L-1)-2,故答案为:
; 2.08(mol?L-1)-2;
(3)①50s内N2O3的浓度变化量为1.48mol?L-1,故NO2的浓度变化量为2.96mol?L-1,据v=
=
=0.0592mol?L-1?s-1,故答案为:0.0592mol?L-1?s-1;
②氢氧燃料电池中,氢气做负极,发生失电子成为氢离子的反应,在熔融盐Na2CO3的作用下,电极反应为:H2+CO32-═CO2+H2O+2e-,故答案为:H2+CO32-═CO2+H2O+2e-.
| 1 |
| 4 |
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氮气的量增加,故T1<T2,故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,故答案为:c;
③当氮气和氢气的物质的量之比为1:3达平衡状态时,氨的百分含量最大,平衡点时产物的产率最大,据图示,当平衡时氢气的物质的量为n,故加入N2的物质的量为
| n |
| 3 |
| [NH3]2 |
| [H2]3?[N2] |
| 1.22 |
| 1.23?0.4 |
| n |
| 3 |
(3)①50s内N2O3的浓度变化量为1.48mol?L-1,故NO2的浓度变化量为2.96mol?L-1,据v=
| △c |
| △t |
| 2.96mol/l |
| 50s |
②氢氧燃料电池中,氢气做负极,发生失电子成为氢离子的反应,在熔融盐Na2CO3的作用下,电极反应为:H2+CO32-═CO2+H2O+2e-,故答案为:H2+CO32-═CO2+H2O+2e-.
点评:本题是热化学和电化学的知识相结合的题目,难度较大,考查学生解决和分析问题的能力.

练习册系列答案
相关题目
 H++HO2-
H++HO2-