题目内容
【题目】(1)硫化氢是一种有剧毒的气体,它的电子式为____________。
(2)最近我国科学家设计了一种![]() 协同转化装置,可以实现对天然气中
协同转化装置,可以实现对天然气中![]() 和
和![]() 的高效去除。示意图如所示,其中电极分别为
的高效去除。示意图如所示,其中电极分别为![]() 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的![]() )和石墨烯,石墨烯电极区发生反应为:
)和石墨烯,石墨烯电极区发生反应为:
a、![]()
b、![]()

①光伏电池所用材料为____________(选填字母)
a. 碳化硅 b. 硅单质 c. 二氧化硅 d. 四氟化硅
②该装置的能量转化形式为_______能转化为______能再转化为______能。
③![]() 石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
石墨烯为______(选填“正极”、“负极”、“阳极”或“阴极”),所发生的电极反应方程式为__________________________________。
(3)硫化氢在工农业生产中也有一定的用途。![]() 和
和![]() 混合加热可以制得羰基硫
混合加热可以制得羰基硫![]() 。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在
。羰基硫可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在![]() 和
和![]() 温度下,在恒容密闭容器中,将一定量
温度下,在恒容密闭容器中,将一定量![]() 和
和![]() 混合加热并达到下列平衡:
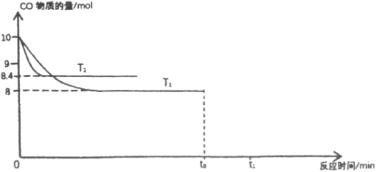
混合加热并达到下列平衡:![]() 。根据图中信息,请回答问题:
。根据图中信息,请回答问题:
①![]() ________
________![]() ,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
,该反应正向_________(选填“吸热”或“放热”或“无法判断”)。
②反应前![]() 投料为_________
投料为_________![]() 。(已知
。(已知![]() 温度下,该反应平衡常数为
温度下,该反应平衡常数为![]() )。
)。
③![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,请补全
倍,请补全![]() 到
到![]() (已达平衡)时间段内的图线_________。
(已达平衡)时间段内的图线_________。
【答案】![]()
![]() 太阳能 电能 化学能 阴极
太阳能 电能 化学能 阴极 ![]() < 放热 7
< 放热 7 
【解析】
(1)硫化氢为共价化合物,原子之间通过共用电子对达到稳定结构书写电子式;
(2)①根据物质的性质与用途作答;
②该装置为光伏电池为电源的电解池;
③CO2在ZnO@石墨烯电极上转化为CO,发生得到电子的还原反应,为阴极,石墨烯电极为阳极,发生失去电子的氧化反应;
(3)根据化学反应速率与平衡图像中,“先拐先平数值大”来判断温度大小;
②![]() 温度下,设H2S的物质的量为x mol,容器体积为V,列出三段式,依据反应平衡常数计算作答。
温度下,设H2S的物质的量为x mol,容器体积为V,列出三段式,依据反应平衡常数计算作答。
③根据反应平衡体系可知,反应是气体体积分数不变的平衡,增大体积平衡不移动。
(1)硫化氢的电子式为:![]() ;
;
(2)①利用硅单质的半导体性能可制成太阳能电池,因此材料为硅单质,b项正确,
答案选b;
②该装置中,硅单质将太阳能(光能)转化为电能后,再利用电解原理将电能转化为化学能,
故答案为:太阳能;电能;化学能;
③由题中信息可知,石墨烯电极上发生氧化反应,则石墨烯电极为阳极,因此,CO2在ZnO@石墨烯电极上转化为CO,发生得到电子的还原反应,为电解池的阴极,电极反应式为CO2+H++2e-=CO+H2O,
故答案为:阴极;CO2+2H++2e-=CO+H2O;
(3)①对于平衡:![]() ,升高温度反应速率会加快,从图像中可以看出,
,升高温度反应速率会加快,从图像中可以看出,![]() ;升高温度,CO的物质的量增大,平衡向逆反应方向移动,则正反应为放热反应,
;升高温度,CO的物质的量增大,平衡向逆反应方向移动,则正反应为放热反应,
故答案为:<;放热反应;
②![]() 温度下,设H2S的物质的量为x mol,容器体积为V,则
温度下,设H2S的物质的量为x mol,容器体积为V,则
![]()

因该反应平衡常数为![]() ,则K=
,则K=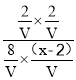 =0.1,则x=7,
=0.1,则x=7,
故答案为:7;
③对于平衡:![]() ,
,![]() 温度下在
温度下在![]() 时刻保持其他条件不变将容器体积扩大为原来的
时刻保持其他条件不变将容器体积扩大为原来的![]() 倍,平衡不移动,则CO的物质的量仍为8mol,其图像补全后为:
倍,平衡不移动,则CO的物质的量仍为8mol,其图像补全后为:
 ,
,
故答案为: 。
。