题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 18g2H2O中含有的中子数为10NA
B. 11.2 LCl2与足量NaOH 溶液反应时转移的电子数为0.5 NA
C. 1mol·L-1的Fe2(SO4)3溶液中含有的SO42-数为3 NA
D. 7 g 乙烯和丁烯的混合气体中所含的碳原子数是0.5 NA
【答案】D
【解析】A,2H2O的摩尔质量为20g/mol,18g2H2O的物质的量n(2H2O)=![]() =0.9mol,其中含中子物质的量为0.9mol
=0.9mol,其中含中子物质的量为0.9mol![]() 10=9mol,A项错误;B,由于Cl2所处温度和压强未知,无法用22.4L/mol计算Cl2物质的量,无法计算Cl2与NaOH溶液反应时转移电子数,B项错误;C,由于溶液的体积未知,无法计算Fe2(SO4)3物质的量,C项错误;D,乙烯的分子式为C2H4,丁烯的分子式为C4H8,两者的实验式都是CH2,7g乙烯和丁烯的混合气体中n(CH2)=
10=9mol,A项错误;B,由于Cl2所处温度和压强未知,无法用22.4L/mol计算Cl2物质的量,无法计算Cl2与NaOH溶液反应时转移电子数,B项错误;C,由于溶液的体积未知,无法计算Fe2(SO4)3物质的量,C项错误;D,乙烯的分子式为C2H4,丁烯的分子式为C4H8,两者的实验式都是CH2,7g乙烯和丁烯的混合气体中n(CH2)=![]() =0.5mol,其中所含碳原子物质的量为0.5mol,D项正确;答案选D。
=0.5mol,其中所含碳原子物质的量为0.5mol,D项正确;答案选D。

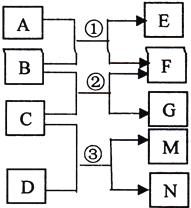
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,化学性质最不活泼的是:_________(填具体元素符号,下同),②③⑤元素的原子半径由大到小的顺序为______________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________/span>,碱性最强的化合物的电子式是:______________________________。
(3) 最高价氧化物是两性氧化物的元素是____;写出该氧化物与氢氧化钠反应的离子方程式_____。
(4) 用电子式表示元素④与⑥的化合物的形成过程:______________,该化合物属于__________(填 “共价”或“离子”)化合物。
(5)写出①与③形成的化合物的电子式____、结构式为___,该化合物的晶体属于_____。
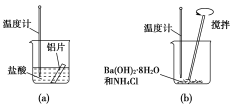
【题目】Ⅰ.水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的某种方法过程如图所示:

(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是_____________,还可使用__________代替硝酸。
(2)沉淀A的主要成分是________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________。
(3)加氨水过程中加热的目的是_____。沉淀B的主要成分为_______、_________(填化学式)。
Ⅱ、已知25℃时草酸的电离常数为K1=5.0×10-2,K2=5.4×10-5.草酸钙的Kap=4.0×10-8.碳酸钙的Ksp=2.5×10-9.不同温度下水的离子积常数见下表:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.00 | 2.92 | 5.57 | 38.0 | 55.0 |
(1)计算25℃时KHC2O4溶液的水解平衡常数Kb=_____;写出水溶液中草酸的电离方程式_____;常温下将0.2mol/L的KOH溶液10mL与0.2mol/L的草酸溶液20mL混合后溶液显________性。(填“酸性”“中性”或“无法确定”)
(2)25℃时向20mL草酸钙的饱和溶液中逐滴加入8.0×10-4mol/L的碳酸钾溶液10mL,能否产生沉淀,_______(填“能”或“否”). 碳酸钙转化为草酸钙的离子方程式为______,列式计算该反的平衡常数K=_________。
(3)90℃时,将0.005mol/L的氢氧化钙溶液20mL与0.0012mol/L的草酸溶液20mL混合,则混合后溶液的pH______。(可能用到的对数:lg38=1.6,lg26=2.4,lg2=0.3)