题目内容
【题目】某同学做如下实验,以探究反应中的能量变化。
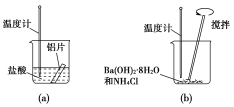
(1)在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,由此可以判断(b)中反应是________热反应。
(2)写出铝与盐酸反应的离子方程式:_______________。
(3)根据能量守恒定律,(b)中反应物的总能量应该________生成物的总能量。
【答案】放 吸2Al+6H+===2Al3++3H2↑低于
【解析】
(1)探究化学反应中的能量变化时,温度升高,则反应放热;温度降低则反应吸热;(2)放热反应中反应物总能量高于生成物,吸热反应中反应物总能量低于生成物,据此分析。
(1)反应后(a)中温度升高,(b)中温度降低,说明(a)中反应为放热反应,(b)中反应为吸热反应;(2)铝与盐酸反应的离子方程式为2Al+6H+=2Al3++3H2↑;(3)(b)中反应为吸热反应,根据能量守恒定律,反应物的总能量应该低于生成物的总能量。

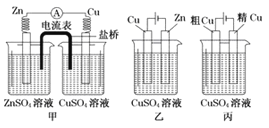
【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。

A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:

①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。