题目内容
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1) 在这些元素中,化学性质最不活泼的是:_________(填具体元素符号,下同),②③⑤元素的原子半径由大到小的顺序为______________________ 。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________/span>,碱性最强的化合物的电子式是:______________________________。
(3) 最高价氧化物是两性氧化物的元素是____;写出该氧化物与氢氧化钠反应的离子方程式_____。
(4) 用电子式表示元素④与⑥的化合物的形成过程:______________,该化合物属于__________(填 “共价”或“离子”)化合物。
(5)写出①与③形成的化合物的电子式____、结构式为___,该化合物的晶体属于_____。
【答案】Ar Al>N>OHClO4![]() AlAl2O3+2OH-=2AlO2-+H2O
AlAl2O3+2OH-=2AlO2-+H2O![]() 离子
离子![]() O=C=O分子
O=C=O分子
【解析】
本题考查元素周期表和元素周期律,熟悉元素在周期表中的位置及元素、化合物的性质是解答本题的关键,根据元素周期表推出各元素的名称为:①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K;再根据元素的性质进行解答。
由元素在周期表中位置,可知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K;(1)Ar为18号元素,核外最外层有8个电子,所以化学性质最不活泼,化学性质最不活泼的是Ar;②为N、③为O知②③同在第二周期,由左到右原子半径逐渐减小,所以半径是N>O;⑤为Al为第三周期元素的原子半径大于第二周期,所以②③⑤原子半径由大到小的顺序为Al>N>O。 答案:Ar Al>N>O。
(2)同周期从左到右元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,同主族从下到上元素的最高价氧化物的水化物酸性逐渐增强,碱性逐渐减弱,所以上述各元素中非金属性最强的是Cl,形成酸性最强的化合物的分子式是HClO4;金属性最强的K,其碱的化学式为KOH,电子式为:![]() 。答案:HClO4
。答案:HClO4 ![]() 。
。
(3) 最高价氧化物是两性氧化物的元素是Al;该氧化物的化学式为Al2O3,与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O。答案为:Al2O3+2OH-=2AlO2-+H2O
(4)上述分析知 ④为Na⑥为S,④与⑥形成的化合物为Na2S,用电子式表示Na2S化合物的形成过程为:![]() ,该化合物属于离子化合物。答案为:
,该化合物属于离子化合物。答案为:![]() 离子。
离子。
(5)由上述分析知①为C、③为O,①与③形成的化合物为CO2,其电子式![]() 结构式是用短线表示共用电子对数,所以CO2的结构简式为O=C=O,该化合物的熔沸点很低,属于分子晶体。答案:
结构式是用短线表示共用电子对数,所以CO2的结构简式为O=C=O,该化合物的熔沸点很低,属于分子晶体。答案:![]() O=C=O 分子。
O=C=O 分子。

 阅读快车系列答案
阅读快车系列答案【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
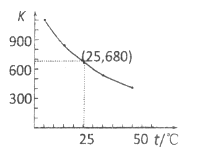
A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:
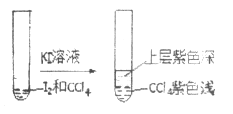
①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。
【题目】研究催化剂对化学反应有重要意义。为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:

(1)甲同学欲用下图所示实验来证明![]() 是
是![]() 分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
分解反应的催化剂。该实验________(填“能”或“不能”)达到目的,原因是___________。
(2)为探究![]() 的量对催化效果的影响,乙同学分别量取
的量对催化效果的影响,乙同学分别量取![]() 1%
1%![]() 加入容器中,在一定质量范围内,加入不同质量的
加入容器中,在一定质量范围内,加入不同质量的![]() ,测量所得气体体积,数据如下:
,测量所得气体体积,数据如下:
| 0.1 | 0.2 | 0.4 |
40s末 | 49 | 61 | 86 |
由此得出的结论是______________。
(3)为分析![]() 和
和![]() 对
对![]() 分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有
分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有![]() )
)
试管 | I | II | III |
滴加试剂 | 5滴 | 5滴 | 5滴0.3 |
产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
结论是___________,实验III的目的是___________。
(4)①查阅资料得知:将作为催化剂的![]() 溶液加入
溶液加入![]() 溶液后,溶液中会发生两个氧化还原反应,且两个反应中
溶液后,溶液中会发生两个氧化还原反应,且两个反应中![]() 均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是__________和___________(按反应发生的顺序写)。
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为![]() 分解反应的催化剂需要满足的条件是___________。
分解反应的催化剂需要满足的条件是___________。
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
