题目内容
1.下列列出的是元素周期表的部分元素,回答下列问题:
表中用字母标出的14种元素中,化学性质最不活泼的是Ar(用元素符号表示即可),金属性最强的是K,非金属性最强的是F,原子半径最大的是K,常温下单质为液体的非金属元素是Br,属于过渡元素的是Fe.
分析 由元素在周期表中位置,可知A为氟、B为氧、C为磷、D为碳、E为Ar、F为Cl、G为硫、H为Al、I为Mg、J为Na、K为Ca、L为钾、M为Fe、N为Br.
稀有气体的化学性质最不活泼;同周期自左而右原子半径减小、非金属性增强,同主族自上而下原子半径增大、非金属性减弱;常温下溴单质为液体,属于过渡元素的是铁.
解答 解:由元素在周期表中位置,可知A为氟、B为氧、C为磷、D为碳、E为Ar、F为Cl、G为硫、H为Al、I为Mg、J为Na、K为Ca、L为钾、M为Fe、N为Br.
稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;同周期自左而右原子半径减小、非金属性增强,同主族自上而下原子半径增大、非金属性减弱,故上述元素中金属性最强的是K,非金属性最强的是 F,原子半径最大的是K;常温下单质为液体的非金属元素是Br,属于过渡元素的是Fe,
故答案为:Ar;K;F;K;Br;Fe.
点评 本题考查元素周期表与元素周期律,比较基础,注意对元素周期表与元素周期律的理解掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
实验流程如下:
请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
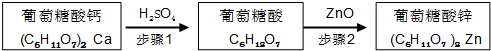
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:

步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
12.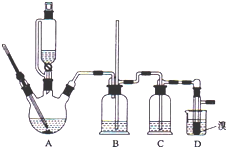 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:
CH3CH2OH→CH2=CH2+H2OC H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如列表如下:
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目的是d;(填正确选 项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母) a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去(填正确选项前的字母);
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去蒸馏;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 实验室制备 1,2-二溴乙烷的反应原理如下:
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH→CH2=CH2+H2OC H2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在 l40℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示,有关数据如列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到 170℃左右,其最主要目的是d;(填正确选 项前的字母)
a.引发反应b.加快反应速度c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置 C 中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体 (填正确选项前的字母) a.水b.浓硫酸c.氢氧化钠溶液d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将 1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量未反应的 Br2,最好用b洗涤除去(填正确选项前的字母);
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚.可用的方法除去蒸馏;
(7)反应过程中应用冷水冷却装置 D,其主要目的是冷却可避免溴的大量挥发,但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
16.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
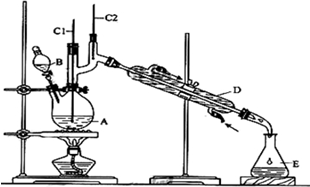
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.

发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{2}}$CH3CH2CH2CHO
反应物和产物的相关数据如下:
| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
回答下列问题:
(1)B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(2)沸石的作用是防止暴沸.
(3)将正丁醛粗产品置于分液漏斗中分液时,水在下层(填“上”或“下”)
(4)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
(5)本实验中,正丁醛的产率为51%.
6.下表列出了A~R九种元素在周期表的位置,用化学用语回答下列问题:
(1)写出R单质分子的电子式 .
.
(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
 .
.(2)A、C、D三种元素的氧化物对应的水化物中碱性最强的是NaOH
(3)A、B、C、G的离子按离子半径由大到小的顺序排列为Cl->K+>Na+>Mg2+
(4)写出A的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
(5)X元素是A~R九种元素中的一种,X的原子核里有14个中子,2.7gX在氧气里燃烧时,质量增加2.4g.X的氢氧化物既能溶于氢氧化钠溶液中反应,也能与盐酸反应.X的元素符号是Al,它位于元素周期表中第三周期、第ⅢA族.
(6)有两种化合物M和N都由AFIJ四种元素组成.若M与N在水溶液中能发生离子反应,则该反应的离子方程式为HSO3-+H+=H2O+SO2↑.
(7)上述元素中最高价氧化物对应的水化物的酸性最强的是HClO4.
7.下列事实不能用勒夏特列原理解释的是( )
| A. | 用排饱和食盐水法收集Cl2 | |
| B. | 冰镇的啤酒打开后泛起泡沫 | |
| C. | 加压有利于合成氨反应 | |
| D. | 金属铝、铁与同浓度的盐酸反应铝的速度快 |
8.分类方法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是( )
| A. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| B. | 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据氧化物中是否含有金属元素将氧化物分为酸性氧化物和碱性氧化物 |