题目内容
11.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→(C6H11O7)2 Ca (葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
(1)第②步中所加CaCO3还发生了其它反应,写出其中一个主要反应的方程式CaCO3+2HBr=CaBr2+CO2↑+H2O;
充分反应后CaCO3固体需有剩余,目的是提高葡萄糖酸的转化率,便于后续分离;
(2)第③步需趁热过滤,原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂,对婴儿及青少年的智力和身体发育有重要作用.工业上以葡萄糖酸钙为原料通过如下两步制备葡萄糖酸锌:
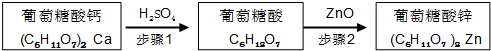
步骤1:充分反应后,过滤除去CaSO4沉淀.
步骤2:将葡萄糖酸溶液与ZnO混合.
(5)步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解.
(6)下列物质可替代ZnO的是be(填字母).
a.NH3•H2O b.Zn(OH)2 c.NaOH d.ZnSO4 e.ZnCO3.
分析 (1)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳;CaCO3固体需有剩余,可使葡萄糖酸完全反应;
(2)趁热过滤,可避免葡萄糖酸钙的损失;
(3)由表中数据可知,葡萄糖酸钙微溶于乙醇,可避免损失;
(4)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去.
(5)须继续加入葡萄糖酸溶液至pH为5.8,抑制锌离子水解;
(6)步骤2为ZnO与葡萄糖酸的反应生成葡萄糖酸锌,不能引入新杂质,则加入不溶性含Zn元素的物质,且与酸反应即可.
解答 解:(1)碳酸钙能与氢溴酸反应生成溴化钙、水和二氧化碳,CaCO3+2HBr=CaBr2+CO2↑+H2O;可使葡萄糖酸完全转化为葡萄糖酸钙,则加入的碳酸钙应过量,
故答案为:CaCO3+2HBr=CaBr2+CO2↑+H2O;提高葡萄糖酸的转化率,便于后续分离;
(2)温度高时,葡萄糖酸钙的溶解度较大,趁热过滤,可避免葡萄糖酸钙的损失,
故答案为:葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(3)由表中数据可知,葡萄糖酸钙微溶于乙醇,用乙醇洗涤可避免损失,有利于葡萄糖酸钙析出,
故答案为:可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(4)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去,可用乙醇-水混合溶液,如只用水,则造成葡萄糖酸钙溶解而损失,只用乙醇,不能将杂质全被洗去;故答案为:D;
(5)因锌离子水解,则步骤2中,待其充分反应后,须继续加入葡萄糖酸溶液至pH为5.8,目的是抑制Zn2+的水解;
故答案为:抑制Zn2+的水解;
(6)a.NH3•H2O与葡萄糖酸反应后引入铵根离子,故a不选;
b.Zn(OH)2 与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故b选;
c.NaOH与葡萄糖酸反应后引入钠离子,故c不选;
d.ZnSO4与葡萄糖酸不反应,故d不选;
e.ZnCO3与葡萄糖反应生成葡萄糖酸锌,且不引人杂质,故e选;
故答案为:be.
点评 本题考查物质的制备、分离和提纯,着重于学生的分析能力和实验能力的考查,有利于培养学生的良好的科学素养,难度中等.

| A. | F2、Cl2、Br2、I2的相对分子质量逐渐增大,熔沸点逐渐升高 | |
| B. | C2Cl6分子中各原子均满足8电子稳定结构 | |
| C. | Cl-、S2-、Ca2+、K+的半径逐渐减小 | |
| D. | 质量数相等的不同核素,一定属于不同种元素 |
 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大
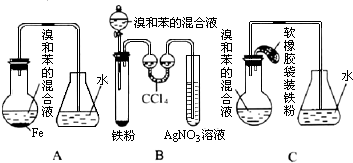
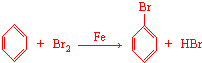 .
.