题目内容
8.分类方法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是( )| A. | 根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等 | |
| B. | 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| D. | 根据氧化物中是否含有金属元素将氧化物分为酸性氧化物和碱性氧化物 |
分析 A、根据酸能电离出的氢离子的个数,将酸分为一元酸、二元酸等;
B、根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应;
C、根据分散系中分散质粒子直径的大小将分散系分为溶液,胶体和浊液;
D、根据氧化物的性质将氧化物分为酸性,碱性和两性氧化物.
解答 解:A、根据酸能电离出的氢离子的个数,将酸分为一元酸、二元酸等,故A错误;
B、根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应,故B正确;
C、根据分散系中分散质粒子直径的大小将分散系分为溶液,胶体和浊液,故C错误;
D、根据氧化物的性质将氧化物分为酸性,碱性和两性氧化物,能和碱反应生成盐和水的氧化物为酸性氧化物,能和酸反应生成盐和水的氧化物称为碱性氧化物,既能和酸又能与碱反应生成盐和水的氧化物称为两性氧化物,故D错误.
故选B.
点评 本题考查了有机物、酸的分类、氧化还原反应和非氧化还原反应的区别等内容,难度不大.

练习册系列答案
相关题目
19.已知使36g焦炭发生不完全燃烧,所得气体中CO占$\frac{1}{3}$体积,CO2占$\frac{2}{3}$体积,已知:
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q1kJ/mol,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是( )
C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-Q1kJ/mol,
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-Q2kJ/mol
与这些焦炭完全燃烧相比较,损失的热量是中正确的是( )
| A. | $\frac{1}{2{Q}_{2}}$ kJ | B. | Q2kJ | C. | $\frac{1}{3({Q}_{1}+{Q}_{2})}$kJ | D. | $\frac{1}{3{Q}_{1}}$kJ |
16.下列反应中均可在溶液中进行,能用同一离子方程式表示的是( )
| A. | NaHCO3、Na2CO3分别与盐酸反应 | B. | NaOH、Cu(OH)2分别与硫酸反应 | ||
| C. | Ca(OH)2、CaCl2分别与Na2CO3反应 | D. | Ba(NO3)2、Ba(OH)2分别与稀硫酸反应 |
3.下列叙述正确的是( )
①氧化还原反应的实质是元素的化合价发生改变
②若1mol气体的体积为22.4L,则它一定处于标准状况下
③标准状况下,1L HCl和1L H2O的物质的量相同
④在熔融状态下可以导电的物质就是电解质
⑤利用丁达尔现象区别溶液和胶体
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比.
①氧化还原反应的实质是元素的化合价发生改变
②若1mol气体的体积为22.4L,则它一定处于标准状况下
③标准状况下,1L HCl和1L H2O的物质的量相同
④在熔融状态下可以导电的物质就是电解质
⑤利用丁达尔现象区别溶液和胶体
⑥两种物质的物质的量相同,则它们在标准状况下的体积也相同
⑦在同温同体积时,气体物质的物质的量越大,则压强越大
⑧同温同压下,气体的密度与气体的相对分子质量成正比.
| A. | 除③外 | B. | ④⑤⑥⑦⑧ | C. | ⑤⑦⑧ | D. | ①⑤⑦⑧ |
13.下列数量的各物质所含原子数按由大到小的顺序排列是( )
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
①0.45mol氨气 ②标准状况下33.6L氦气 ③4℃时7.5mL水 ④0.2mol磷酸钠(Na3PO4)
| A. | ①④②③ | B. | ②①④③ | C. | ②①③④ | D. | ①④③② |
20.等物质的量的下列物质在一定条件下与足量浓硝酸反应生成NO2,消耗硝酸的物质的量最多的是( )
| A. | Ag | B. | FeI2 | C. | SO2 | D. | C |
17.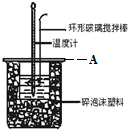 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热为△H=-51.8kJ/mol;
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
 分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
分别取40mL 的0.50mol/L盐酸与 0.55mol/L NaOH溶液进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O (l)△H=-57.3 kJ/mol;
(2)A为泡沫塑料板,上面有两个小孔,分别插入温度计和环形玻璃棒,两个小孔不能开得过大,其原因是减少热量散失;反应需要测量温度,每次测量温度后都必须用水将温度计上的液体冲掉,并擦干温度计;
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).实验时,还需测量的数据有ACE;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
(5)假定该学生的操作完全同上,实验中改用100mL 0.50mol/L盐酸跟100mL0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
17.人体血红蛋白中不可缺少的是( )
| A. | 单质的铁或铝 | B. | 铁离子的化合物 | C. | 铁元素 | D. | 铝元素 |
