题目内容
13.下列排列顺序正确的是( )①第一电离能Na<Al<Mg ②热稳定性:H2O>HF>NH3
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力OH->CH3COO->Cl-
⑤还原性:HF<HCl<HBr<HI ⑥离子半径:Ca2+<K+<Cl-<S2-.
| A. | ①②③④ | B. | ①④⑤⑥ | C. | ②③④⑤ | D. | ③④⑤⑥ |
分析 ①同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
②元素的非金属性越强,其氢化物的稳定性越强;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强;
④酸或酸电离出氢离子能力越强,其阴离子结合质子能力越弱;
⑤元素的非金属性越强,其氢化物的还原性越弱;
⑥电子层结构相同的离子,离子半径随着原子序数增大而减小.
解答 解:①同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,Na、Mg、Al分别位于第IA族、第IIA族、第IIIA族,所以第一电离能Mg>Al>Na,故正确;
②元素的非金属性越强,其氢化物的稳定性越强,非金属性F>O>N,所以热稳定性:HF>H2O>NH3,故错误;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以酸性H3PO4<H2SO4<HClO4,故错误;
④酸或酸电离出氢离子能力越强,其阴离子结合质子能力越弱,电离出氢离子能力HCl>CH3COOH>H2O,所以结合质子能力OH->CH3COO->Cl-,故正确;
⑤元素的非金属性越强,其氢化物的还原性越弱,非金属性F>Cl>Br>I,所以还原性:HF<HCl<HBr<HI,故正确;
⑥电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Ca2+<K+<Cl-<S2-,故正确;
故选B.
点评 本题考查元素周期律的应用,明确同一周期、同一主族元素性质递变规律即可解答,侧重考查学生分析判断能力,知道非金属性、金属性强弱判断方法,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
3.下列各组物质与其用途的关系正确的是( )
| A. | 碘化钾--食盐中的加碘物质 | B. | 二氧化硅--太阳能电池 | ||
| C. | 福尔马林--食品保鲜剂 | D. | 水玻璃--耐火材料 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 | |
| B. | 已知2 H2(g)+O2(g)=2 H2O(g)△H=-483.6 kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1 | |
| C. | 已知2 C(s)+2 O2(g)=2 CO2(g)△H=a 2 C(s)+O2(g)=2 CO(g)△H=b,则a>b | |
| D. | 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定 |
1.下列关于稀有气体的叙述不正确的是( )
| A. | 原子的最外层电子排布不一定都是以p6结束 | |
| B. | 化学性质非常不活泼 | |
| C. | 其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式 | |
| D. | 原子半径比同周期ⅦA族元素原子的大 |
8.下列描述中正确的是( )
| A. | CS2为直线形的极性分子 | |
| B. | CH4中键能、键长和键角均相同 | |
| C. | AB2为V形,则A一定为sp2杂化 | |
| D. | SiF4和SO32-的中心原子均为sp2杂化 |
18.从甜橙的芳香油中可分离得到如下结构的化合物: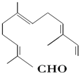 现有试剂:
现有试剂:
①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
 现有试剂:
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2碱性悬浊液,能与该化合物中所有官能团都发生反应的试剂有( )
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
5.X元素最高价氧化物对应水化物化学式为H4XO4,则对应的氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH4 |
2.为将反应2Al+6H+═2Al3++3H2↑的化学能转化为电能,下列装置能达到目的是(铝条均已除去了氧化膜)( )
| A. | 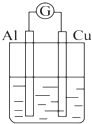 NaOH溶液 | B. | 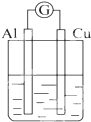 稀硫酸 | C. | 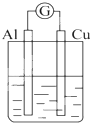 稀硝酸 | D. | 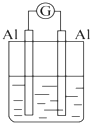 稀盐酸 |
3. 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到图1,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | C(HCL)(mol/L) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 3-4-1-2 | B. | 1-2-4-3 | C. | 4-2-3-1 | D. | 4-3-2-1 |