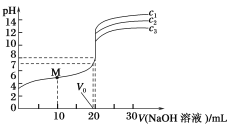
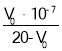题目内容
【题目】某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
A.至少存在3种离子
B.Cl-一定存在,且c(Cl)≥0.4mol/L
C.SO42-、NH4+、一定存在,Cl-可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
【答案】B
【解析】
加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,物质的量为0.02mol;红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,物质的量为![]() ;Fe3+与CO32-不能共存,则一定没有CO32-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,则溶液中含有SO42-,物质的量为
;Fe3+与CO32-不能共存,则一定没有CO32-;4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,则溶液中含有SO42-,物质的量为![]() ;
;
A. 由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,故A错误;
B. 由电荷守恒可知,Cl-一定存在,且c(Cl-)≥0.4mol/L,故B正确;
C. 由上述分析可知,SO42-、NH4+、Fe3+、Cl-一定存在,故C错误;
D. 综上所述,原溶液中一定含Fe3+、NH4+、SO42-和Cl-,可能含Al3+、K+,一定不含CO32-,故D错误;
故选B。

【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。