题目内容
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
【答案】蒸馏 检查是否漏水 上 除去HCl 除去少量NaHCO3且减少产物损失 dcab 拆去连接抽气泵和吸滤瓶的橡皮管 关闭抽气泵
【解析】
间苯三酚和氯化氢的甲醇溶液反应后,生成3,5-二甲氧基苯酚,同时产品中还含有过量的甲醇,HCl和水,然后除去其中的这些杂质即可。
(1)根据表中给出的物理性质数据,除去甲醇可采用蒸馏,之后利用3,5-二甲氧基苯酚易溶于乙醚、微溶于水的性质,加入乙醚进行萃取,静置后分层,乙醚的密度比水小,因而有机层在上层。
(2)分离后的有机层,除了产品3,5-二甲氧基苯酚,还有乙醚,HCl,水。利用这些物质的物理化学性质差异,先加入饱和的NaHCO3溶液洗涤,除去HCl,再加入饱和食盐水除去过量的NaHCO3,同时又减少了产物3,5-二甲氧基苯酚的溶解度,减少溶解的损失。
(3)洗涤后的产品中还有乙醚和水两种杂质。操作是先除水再除乙醚。除水先加入加入无水CaCl2干燥,然后过滤,除去干燥剂,之后蒸馏除去乙醚,再采用重结晶的方法得到纯度较高的产品。正确的顺序是:dcab。
(4)减压过滤时,当漏斗颈下再无液滴滴下时,可判断已抽吸干燥,此时过滤完全,先拔掉连接抽气泵和吸滤瓶的橡皮管,后关抽气泵,以免循环水真空抽气泵中的水倒吸污染滤液。本问要理解减压过滤的原理。

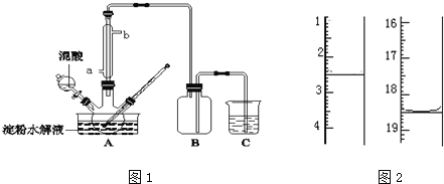
【题目】已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过如图所示装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)。
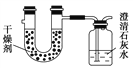
实验前 | 实验后 | |
干燥剂和U形管的质量 | 101.1 g | 102.9 g |
石灰水和广口瓶的质量 | 312.0 g | 314.2 g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为________ g,假设广口瓶里生成一种正盐,其质量为________ g。
(2)生成的水中氢元素的质量为________ g。
(3)生成的CO2中碳元素的质量为________ g。
(4)该燃料中碳、氢元素的质量比为________。
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。