题目内容
卤族元素及其化合物与社会、生活关系密切。下列有关说法不正确的是( )
| A.加碘食盐中加入的是碘酸钾 |
| B.常用于杀菌消毒的84消毒液的成分是液氯 |
| C.可用硝酸银溶液来鉴别纯净水和自来水 |
| D.变色眼镜和照相器材的生产都要用到溴化银 |
B
加碘食盐中加入的是碘酸钾,A正确;84消毒液的有效成分是NaClO溶液,B错;自来水一般是用氯气来消毒的,其中含有Cl-,与AgNO3溶液反应生成AgCl白色沉淀,C正确;溴化银具有感光性,常用于变色眼镜和照相器材的生产,D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
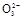
 2I-+S4
2I-+S4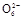 ),共用去V mL硫代硫酸钠溶液。
),共用去V mL硫代硫酸钠溶液。

 。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则
。为模拟上述反应,准确称取0. 508g碘、0.736g金属钨置于50. 0mL的密闭容器中,加热使其反应。如图是 WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则


 ]。
]。