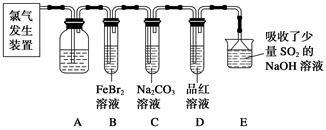
题目内容
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |
D
Cl2与水发生反应:Cl2+H2O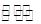 H++Cl-+HClO,反应达平衡后,再通入Cl2,溶液仍然是饱和溶液,各离子浓度以及离子浓度比均不发生变化;通入SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,故溶液漂白性降低;往氯水中加入少量NaOH固体,溶液pH会增大,且溶液中存在电荷守恒:
H++Cl-+HClO,反应达平衡后,再通入Cl2,溶液仍然是饱和溶液,各离子浓度以及离子浓度比均不发生变化;通入SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,故溶液漂白性降低;往氯水中加入少量NaOH固体,溶液pH会增大,且溶液中存在电荷守恒:
c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),由于NaOH固体少量,故溶液显酸性,c(H+)>c(OH-),所以c(Na+)<c(Cl-)+c(ClO-)。
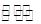 H++Cl-+HClO,反应达平衡后,再通入Cl2,溶液仍然是饱和溶液,各离子浓度以及离子浓度比均不发生变化;通入SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,故溶液漂白性降低;往氯水中加入少量NaOH固体,溶液pH会增大,且溶液中存在电荷守恒:
H++Cl-+HClO,反应达平衡后,再通入Cl2,溶液仍然是饱和溶液,各离子浓度以及离子浓度比均不发生变化;通入SO2发生反应:Cl2+SO2+2H2O=2HCl+H2SO4,故溶液漂白性降低;往氯水中加入少量NaOH固体,溶液pH会增大,且溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(ClO-),由于NaOH固体少量,故溶液显酸性,c(H+)>c(OH-),所以c(Na+)<c(Cl-)+c(ClO-)。

练习册系列答案
相关题目