��Ŀ����
±�ص��ʵ����ʻ��ã�±�صĻ�����Ӧ�ù㷺�����û�ѧ��Ӧԭ���о�±��Ԫ�ص��й����ʾ�����Ҫ���塣
��1�����й�����ˮ��������ȷ����_______����д��ţ���
A����ˮ�д������ֵ���ƽ��
B������ˮ��ͨ��SO2����Ư������ǿ
C������ˮ��ͨ��������c( H��)/c(ClO��)��С
D����ˮϡ����ˮ����Һ�е���������Ũ�Ⱦ���С
E����ˮϡ����ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ�
F������ˮ�м���������NaOH��������c(Na��)=c(Cl�� )+c(ClO��)
��2����ҵ��ͨ���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ______��
��3�������£���֪25��ʱ�й�����ĵ���ƽ�ⳣ����

д��84����Һ����Ҫ�ɷ�ΪNaClO��¶���ڿ����з�����Ӧ���йػ�ѧ����ʽ________������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᵼ���ж����������ӷ���ʽ�����й�ԭ��___________��
��4�����ٵƾ��бȰ׳���������һ������ܵģ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ�� ��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����
��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����

�ٸ÷�Ӧ�ġ�H_______0���>����=��<����
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2)=_________��
������˵���в���ȷ����_________������ţ���
A�����ø÷�Ӧԭ�������ᴿ��
B���÷�Ӧ��ƽ�ⳣ������ʽ��K=
C����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
��5��25��ʱ����5mL����KCI��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0��1mol/L��AgNO3��Һ�������ɵij�����_________����Һ������Ũ���ɴ�С��˳����_______ [������H����OH����25��ʱ
 ]��
]��
��1�����й�����ˮ��������ȷ����_______����д��ţ���
A����ˮ�д������ֵ���ƽ��
B������ˮ��ͨ��SO2����Ư������ǿ
C������ˮ��ͨ��������c( H��)/c(ClO��)��С
D����ˮϡ����ˮ����Һ�е���������Ũ�Ⱦ���С
E����ˮϡ����ˮ��ˮ�ĵ���ƽ��������Ӧ�����ƶ�
F������ˮ�м���������NaOH��������c(Na��)=c(Cl�� )+c(ClO��)
��2����ҵ��ͨ���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ______��
��3�������£���֪25��ʱ�й�����ĵ���ƽ�ⳣ����

д��84����Һ����Ҫ�ɷ�ΪNaClO��¶���ڿ����з�����Ӧ���йػ�ѧ����ʽ________������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᵼ���ж����������ӷ���ʽ�����й�ԭ��___________��
��4�����ٵƾ��бȰ׳���������һ������ܵģ��ص㡣һ���¶��£������ڷ�����������ʹ�ù����г����ڹܱ��ϵ��ٿ��Է�����Ӧ��
 ��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����
��Ϊģ��������Ӧ��ȷ��ȡ0. 508g�⡢0.736g����������50. 0mL���ܱ������У�����ʹ�䷴Ӧ����ͼ�� WI2(g)�����ʵ�����ʱ��仯��ϵͼ����������I��0��t2ʱ��Σ��ķ�Ӧ�¶�ΪT1������II(��t2��ʼ)�ķ�Ӧ�¶�ΪT2����T2>T1����
�ٸ÷�Ӧ�ġ�H_______0���>����=��<����
�ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2)=_________��
������˵���в���ȷ����_________������ţ���
A�����ø÷�Ӧԭ�������ᴿ��
B���÷�Ӧ��ƽ�ⳣ������ʽ��K=

C����˿�����¶�Խ�ߣ���˿��������WI2Խ�ױ�ΪW�����³�������˿��
��5��25��ʱ����5mL����KCI��KIŨ�Ⱦ�Ϊ0.1mol/L�Ļ��Һ�У��μ�6mL0��1mol/L��AgNO3��Һ�������ɵij�����_________����Һ������Ũ���ɴ�С��˳����_______ [������H����OH����25��ʱ

 ]��
]����1��A E F
��2��2Cl-+2H2O 2OH-+Cl2��+H2��
2OH-+Cl2��+H2��
��3��NaClO+CO2+ H2O=HClO+NaHCO3 ; 2HClO 2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O��
2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O��
��4���� < �� 0.036/t1mol/(L��min) �� B
��5��AgI c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
��2��2Cl-+2H2O
 2OH-+Cl2��+H2��
2OH-+Cl2��+H2����3��NaClO+CO2+ H2O=HClO+NaHCO3 ; 2HClO
 2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O��
2HCl+O2����ClO-+Cl-+2H+= Cl2��+H2O����4���� < �� 0.036/t1mol/(L��min) �� B
��5��AgI c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
�����������1������ˮ�д�������������ʣ�H2O��HClO�����Ƕ������ŵ���ƽ��H2O
 H++OH-��HClO
H++OH-��HClO H++ClO-����ȷ��B. ����ˮ��ͨ��SO2��������Ӧ��Cl2��SO2��2H2O=H2SO4��2HCl��������H2SO4��HCl��û��Ư���ԡ����Ư�����ü�����C������ˮ��ͨ��������ƽ�⣺Cl2+H2O
H++ClO-����ȷ��B. ����ˮ��ͨ��SO2��������Ӧ��Cl2��SO2��2H2O=H2SO4��2HCl��������H2SO4��HCl��û��Ư���ԡ����Ư�����ü�����C������ˮ��ͨ��������ƽ�⣺Cl2+H2O  H++Cl-+HClO�����ƶ���c(H+) ����HClO
H++Cl-+HClO�����ƶ���c(H+) ����HClO H++ClO-�����ƶ���c(ClO-) ��С��c( H��)/c(ClO��)������D����ˮϡ����ˮ����Һ�е�H+��ClO-��Cl-����Ũ�ȼ�С��������c(H+)��c(OH-)=Kw.����c(OH-)������E����ˮϡ����ˮ������Cl2+H2O
H++ClO-�����ƶ���c(ClO-) ��С��c( H��)/c(ClO��)������D����ˮϡ����ˮ����Һ�е�H+��ClO-��Cl-����Ũ�ȼ�С��������c(H+)��c(OH-)=Kw.����c(OH-)������E����ˮϡ����ˮ������Cl2+H2O  H++Cl-+HClO�����ƶ�������������c(H+) ��С����ˮ���������ü���������ˮ�ĵ���ƽ��������Ӧ�����ƶ�����ȷ��F������ˮ�м���������NaOH��������ӦCl2+NaOH= NaCl+NaClO����ǡ����ȫ��Ӧ����c(Na��)=c(Cl�� )+c(ClO��)����ȷ��������ȷѡ��ΪA��E��F����2���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O
H++Cl-+HClO�����ƶ�������������c(H+) ��С����ˮ���������ü���������ˮ�ĵ���ƽ��������Ӧ�����ƶ�����ȷ��F������ˮ�м���������NaOH��������ӦCl2+NaOH= NaCl+NaClO����ǡ����ȫ��Ӧ����c(Na��)=c(Cl�� )+c(ClO��)����ȷ��������ȷѡ��ΪA��E��F����2���ȼҵ�����������䷴Ӧ�����ӷ���ʽΪ2Cl-+2H2O 2OH-+ Cl2��+H2��.��3���ɵ���ƽ�ⳣ��H2CO3>HClO>HCO3-����֪��H2CO3>HClO�����84����Һ¶���ڿ����з�����Ӧ���йػ�ѧ����ʽNaClO+CO2+ H2O=HClO+NaHCO3��2HClO
2OH-+ Cl2��+H2��.��3���ɵ���ƽ�ⳣ��H2CO3>HClO>HCO3-����֪��H2CO3>HClO�����84����Һ¶���ڿ����з�����Ӧ���йػ�ѧ����ʽNaClO+CO2+ H2O=HClO+NaHCO3��2HClO 2HCl+O2������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᷢ����Ӧ��ClO-+Cl-+2H+= Cl2��+H2O�����ж�������Cl2�����ж�����4������Ϊ�����¶ȣ�WI2��ƽ�⺬�����ͣ�˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ����˦�H <0. �ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2) =v(WI2)= ��c/��t=1.80��10-3mol/0.05L��t1min="0.036/t1mol/(L��min)" .��A. ʹ�ò����ĵ�W��I2������Ӧ��ȡ����WI2������Ӧ�ﵽƽ��������¶ȣ�ƽ�������ƶ������ܲ��������ĵ���W����˿����ø÷�Ӧԭ�������ᴿ�١���ȷ��B. ����W�ǹ��壬Ũ�Ȳ���ı䣬���Ը÷�Ӧ��ƽ�ⳣ������ʽ��
2HCl+O2������84����Һ����������Ũ���ᣩ���ʹ�ÿ��ܻᷢ����Ӧ��ClO-+Cl-+2H+= Cl2��+H2O�����ж�������Cl2�����ж�����4������Ϊ�����¶ȣ�WI2��ƽ�⺬�����ͣ�˵�������¶ȣ���ѧƽ�����淴Ӧ�����ƶ�������ƽ���ƶ�ԭ���������¶ȣ���ѧƽ�������ȷ�Ӧ�����ƶ����淴Ӧ����Ϊ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ����˦�H <0. �ڴӷ�Ӧ��ʼ��t1ʱ���ڵ�ƽ����Ӧ����v(I2) =v(WI2)= ��c/��t=1.80��10-3mol/0.05L��t1min="0.036/t1mol/(L��min)" .��A. ʹ�ò����ĵ�W��I2������Ӧ��ȡ����WI2������Ӧ�ﵽƽ��������¶ȣ�ƽ�������ƶ������ܲ��������ĵ���W����˿����ø÷�Ӧԭ�������ᴿ�١���ȷ��B. ����W�ǹ��壬Ũ�Ȳ���ı䣬���Ը÷�Ӧ��ƽ�ⳣ������ʽ��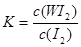 ������C����˿�����¶�Խ�ߣ��ṹƽ���ƶ�ԭ����֪:��˿��������WI2�ͻ������ƶ������������W�����³�������˿�ϡ���ȷ����5������Ksp(AgI)< Ksp(AgI).�������Ȳ����ij���ΪAgI���ڻ��ǰn(K+)=(5mL+5mL)��10-3L/mL��0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L��0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L��0.1mol/L=0.0005mol;�ڻ����Һ��K+��NO3-�����ģ�������Ӧ��Ag++I-=AgI����Ag++Cl-=AgCl��.�������ĵ��������ʵ�������ȷ����Һ�����ӵ�Ũ�ȴ�С��ϵΪ��c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
������C����˿�����¶�Խ�ߣ��ṹƽ���ƶ�ԭ����֪:��˿��������WI2�ͻ������ƶ������������W�����³�������˿�ϡ���ȷ����5������Ksp(AgI)< Ksp(AgI).�������Ȳ����ij���ΪAgI���ڻ��ǰn(K+)=(5mL+5mL)��10-3L/mL��0.1mol/L=0.001mol;n(Ag+)=n(NO3-)=0.006L��0.1mol/L=0.0006mol;n(Cl-)=n(I-)=0.005L��0.1mol/L=0.0005mol;�ڻ����Һ��K+��NO3-�����ģ�������Ӧ��Ag++I-=AgI����Ag++Cl-=AgCl��.�������ĵ��������ʵ�������ȷ����Һ�����ӵ�Ũ�ȴ�С��ϵΪ��c(K+)> c(NO3-)> c(Cl-)> c(Ag+)> c(I-).
��ϰ��ϵ�д�
 ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�
�����Ŀ
 MnCl2+2H2O+Cl2��
MnCl2+2H2O+Cl2�� CaCl2+2H2O
CaCl2+2H2O 2KCl+3O2��
2KCl+3O2��

