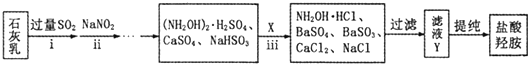
题目内容
13.有Fe、CuO和Fe2O3组成的混合物共mg,放人500mL1mol•L-1 HNO3溶液中,混合物完全溶解,生成2.24L(标准状况下)NO,再向反应后的溶液中加入200mL NaOH溶液,要使铁和铜元素完全沉淀下来,所加入的NaOH溶液的浓度最小是( )| A. | 1mol•L-1 | B. | 1.5mol•L-1 | C. | 2mol•L-1 | D. | 2.5mol•L-1 |
分析 反应中硝酸体现两种性质,一是酸性,以NO3-离子存在溶液中,另一种是氧化性,被还原为NO,加入NaOH后使铁和铜元素完全沉淀下来,此时溶液的溶质为硝酸钠,根据N元素守恒可知n(NaOH)=n(NO3-)=n(HNO3)-n(NO),再根据c=$\frac{n}{V}$进行计算所加入的NaOH溶液的最小浓度.
解答 解:500mL 1mol•L-1 HNO3溶液中含有HNO3的物质的量为:0.5L×1mol/L=0.5mol,生成NO的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,
所以与一定量Fe、CuO和Fe2O3的混合物反应后溶液中含有的NO3-的物质的量为:0.5mol-0.1mol=0.4mol,
再向反应后的溶液中加入200mLNaOH溶液,要使铁和铜元素全部沉淀下来,所得溶液的溶质为NaNO3,
所以需要NaOH的物质的量为:n(NaOH)=n(NO3-)=0.4mol,
则所加NaOH溶液的最小浓度为:$\frac{0.4mol}{0.2L}$=2mol/L,
故选C.
点评 本题考查化合物反应的计算,题目难度中等,注意利用N元素质量守恒计算较为简单,关键是找出n(NaOH)=n(NO3-)的关系,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | NaCl | C. | H2SO4 | D. | 盐酸 |
4.下列有关化学用语使用正确的是( )
| A. | CO2的电子式: | B. | 核内有8个中子的碳原子:${\;}_{6}^{8}$C | ||
| C. | 钾离子结构示意图: | D. | N原子的电子排布式:1s22s22p3 |
8.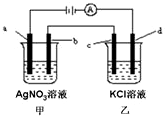 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 当b极增重5.4g时,d极产生的气体为2.24L | |
| B. | 乙烧杯中的d电极反应式为Fe-2e-=Fe2+ | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀 | |
| D. | 甲烧杯中溶液的pH降低 |
10.下列各组物质中,从左到右熔点由高到低的是( )
| A. | HBr、HCl、HF | B. | CO2、NaCl、SiO2 | C. | I2、CO2、Hg | D. | Li、Na、K |
7.(1)25℃,有pH=12的氢氧化钠溶液100ml,欲使它的pH降为11.如果加蒸馏水应加入900ml;如果加入0.008mol/L的盐酸溶液,应加入100ml.
(2)25℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈碱性.(选填“酸性”、“中性”或“碱性”)
(3)已知相关物质的溶度积常数见下表:
某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入Cu(OH)2、CuO、CuCO3或Cu2(OH)2CO3,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(4)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在氯化氢气流中加热脱水.
(2)25℃,pH=3盐酸和pH=11氨水等体积混合后溶液呈碱性.(选填“酸性”、“中性”或“碱性”)
(3)已知相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(4)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在氯化氢气流中加热脱水.