题目内容
8.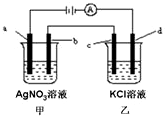 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A. | 当b极增重5.4g时,d极产生的气体为2.24L | |
| B. | 乙烧杯中的d电极反应式为Fe-2e-=Fe2+ | |
| C. | 当电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀 | |
| D. | 甲烧杯中溶液的pH降低 |
分析 a与电源正极相连,为阳极,则b为阴极,甲中阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag;乙中c为阳极,发生2Cl--2e-=Cl2↑,d为阴极发生2H++2e-=H2↑,以此来解答.
解答 解:A.b极增重5.4g时,n(Ag)=$\frac{5.4g}{108}$=0.05mol,由2Ag~2e-~H2↑,则d极产生的气体为0.025mol×22.4L/mol=0.56L,故A错误;
B.乙中d为阴极,发生2H++2e-=H2↑,故B错误;
C.当电解一段时间后,甲可能为硝酸,乙为KOH,则二者混合不会生成沉淀,故C错误.
D.通电一段时间后,甲中阳极发生4OH--4e-=2H2O+O2↑,阴极发生4Ag++4e-=4Ag,反应后为硝酸,溶液pH减小,故D正确;
故选D.
点评 本题考查电解原理,明确发生的电极反应是解答本题的关键,注意图中阳极的判断及溶液中离子的放电顺序即可解答,题目难度中等.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
19.分类是生活、学习和科学研究中常用的一种方法.下列物质的分类正确的是( )
| A. | 碳酸钠、碳酸钾、碳酸钙都属于可溶性的碳酸盐 | |
| B. | 盐酸、硫酸、硝酸都属于含氧酸 | |
| C. | 氢氧化钠、氢氧化钡、氢氧化钾都属于一元碱 | |
| D. | 生石灰、水、五氧化二磷都属于氧化物 |
13.有Fe、CuO和Fe2O3组成的混合物共mg,放人500mL1mol•L-1 HNO3溶液中,混合物完全溶解,生成2.24L(标准状况下)NO,再向反应后的溶液中加入200mL NaOH溶液,要使铁和铜元素完全沉淀下来,所加入的NaOH溶液的浓度最小是( )
| A. | 1mol•L-1 | B. | 1.5mol•L-1 | C. | 2mol•L-1 | D. | 2.5mol•L-1 |
5.将质量为a克的甲烷、甲醇和甲醛分别完全燃烧后的产物冲入足量的Na2CO3吸收,固体质量增加量之比为( )
| A. | 1:1:1 | B. | 2:2:1 | C. | 8:16:15 | D. | 2:1:1 |
2.下列物质不属于糖类的是( )
| A. | 葡萄糖 | B. | 植物油 | C. | 纤维素 | D. | 淀粉 |
3.下列溶液中有关微粒的物质的量浓度的比较正确的是( )
| A. | 常温下两种溶液①0.1mol/L CH3COOH溶液 ②0.3mol/L CH3COOH溶液与0.1mol/LNaOH溶液等体积的混合液 c(H+):①<② | |
| B. | 常温下将NaHCO3与NaHSO3混合溶于水,恰好呈中性的溶液中:c(Na+)=c(HCO3-)+c(HSO3-)+2c(CO32-)+2c(SO32-) | |
| C. | 相同条件下,pH=9的①CH3COONa溶液、②NH3•H2O溶液、③NaOH溶液中由水电离出的c(OH-):①>②>③ | |
| D. | 已知酸性HF>CH3COOH,物质的量浓度相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)] |