题目内容
【题目】某原子含有6个电子、7个中子,它的化学符号为( )
A.13C
B.13Al
C.13C
D.13Al
【答案】A
【解析】解:质子数=原子序数,质子数决定元素种类,所以含有6个电子的原子质子数为6,元素是C,并且质子数+中子数=质量数,所以该元素的质量数是1,3,表示为613C,故选A.
【考点精析】通过灵活运用常见元素的名称、符号、离子符号,掌握元素符号:①表示一种元素(宏观上).②表示一种元素的一个原子(微观上).③表示该元素的相对原子质量;离子符号:在元素符号右上角标电荷数及电性符号(正负号),“l”省略不写如:Ca2+、SO42ˉ、C1ˉ、Na+ …即可以解答此题.

【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有大小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5molL﹣1盐酸、0.55molL﹣1NaOH溶液,实验尚缺少的玻璃用品是 .
(2)①实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是 . ②在大、小烧杯之间填满碎泡沫塑料的作用是 .
(3)他们记录的实验数据如表:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | △H | |||
① | 50 mL 0.55 molL﹣1 NaOH溶液 | 50 mL 0.5 molL﹣1 HCl溶液 | 20℃ | 23.3℃ | kJ/mol |
② | 50 mL 0.55 molL﹣1 NaOH溶液 | 50 mL 0.5 molL﹣1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18kJ℃﹣1kg﹣1 , 各物质的密度均为1gcm﹣3 . 计算完成上表(保留两位小数).
(4)实验分析 ①若用醋酸代替HCl做实验,测得的中和热的数值(填“偏大”或“偏小”或“无影响”).
②若用60mL 0.5molL﹣1HCl溶液与50mL 0.55molL﹣1NaOH溶液完成实验,与上述实验相比,测得反应放出的热量(填“偏大”或“偏小”或“不变”),中和热(填“偏大”或“偏小”或“不变”)
【题目】三氯氧磷(POCl3)是一种重要的化工原料,工业上可以直接氧化PCl3制备POCl3,反应原理为:P4(白磷)+6Cl2=4PCl3 2PCl3+O2=2POCl3
PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如下(某些夹持装置、加热装置已略去) :
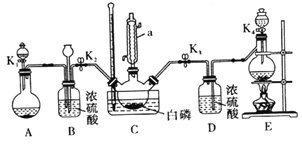
(1)仪器a 的名称为_______________,B装置中长颈漏斗的作用是___________________。
(2)装置E用来制取Cl2,反应的离子方程式为_____________________。
(3)为使实验顺利进行,还需补充的装置为____________________。
(4)反应时,需严格控制三个条件:
①先制取___________,缓慢地通入C 中,直至C 中的白磷消失后,再通入另一种气体。
②C装置用水浴加热控制温度为60 ℃~65℃,除加快反应速率外,另一目的是___________________。
③反应物必须干燥,否则会在C 装置中产生大量的白雾,其主要成分为___________(写化学式)。
(5)反应结束后通过下面步骤测定POCl3产品中Cl 的含量,元素Cl 的质量分数为_______________(写出计算式)。
Ⅰ.取xg产品于锥形瓶中,加入足量NaOH 溶液,POCl3完全反应后加稀硝酸至酸性;
Ⅱ.向锥形瓶中加入0.1000 mol/L 的AgNO3 溶液40.00 mL,使Cl-完全沉淀;
Ⅲ.再向锥形瓶中加入20mL硝基苯,振荡,使沉淀表面被有机物覆盖;
Ⅳ.然后加入指示剂,用c mol/LNH4SCN溶液滴定过量Ag+ 至终点,记下所用体积为VmL。
(己知:AgPO4溶于酸,Ksp(AgCl )=32×10-10,Ksp(AgSCN )=2×10-12)
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
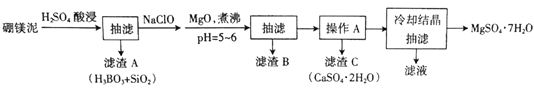
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
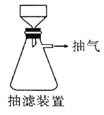
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。