题目内容
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
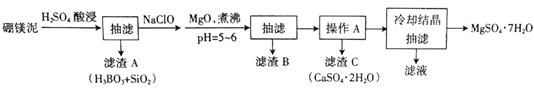
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
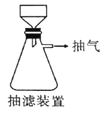
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
【答案】 适当增加硫酸浓度、提高反应温度、搅拌等 (任写两条,答案合理即可) Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓ ClO-+Mn2++H2O=MnO2↓+Cl-+2H+ 使Fe、Al转化为氢氧化物沉淀除去 蒸发结晶 趁热过滤 过滤速度快,得到的沉淀较干燥 70%
【解析】(1)为提高酸浸时浸出速率,可采取的措施有适当增加硫酸浓度、提高反应温度、搅拌等;正确答案:适当增加硫酸浓度、提高反应温度、搅拌等 (任写两条,答案合理即可)。
(2)根据反应的流程可知,H2SO4和Na2B4O7发生反应生成H3BO3沉淀和硫酸钠,化学方程式为Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓ ;正确答案:Na2B4O2+H2SO4+5H2O=Na2SO4+4H3BO3↓。
(3)根据题意可知, NaClO具有氧化性,能够把锰离子氧化为二氧化锰,亚铁离子氧化为铁离子,只有二氧化锰不溶于水的黑色固体,则该反应的离子方程式为ClO-+Mn2++H2O=MnO2↓+Cl-+2H+;正确答案:ClO-+Mn2++H2O=MnO2↓+Cl-+2H+。
(4)加入NaClO溶液后,亚铁离子氧化为铁离子,根据金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2可知,加MgO煮沸,并调整溶液pH=5~6的目的是使Fe3+、Al3+变为沉淀而除去;正确答案:使Fe、Al转化为氢氧化物沉淀除去。
(5) 由表中数据可知,硫酸钙的溶解度随温度的变化不大,硫酸镁的溶解度随温度变化较大,因此可以采用蒸发结晶、趁热过滤的操作除去MgSO4和CaSO4混合溶液中的CaSO4;正确答案:蒸发结晶;趁热过滤。
(6)相比普通过滤,抽滤的优点是过滤速度快,得到的沉淀较干燥;正确答案:过滤速度快,得到的沉淀较干燥。
(7) 硼镁泥主要成分是MgO(占40%),提供的硼镁泥共100g,所以氧化镁的质量为40 g,物质的量为1mol,理论上产生MgSO4·7H2O的量为1mol,质量为246 g,则MgSO4·7H2O的产率为172.2/246 ×100%= 70%;正确答案:70%。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】现有一瓶A和B的混合液,已知它们的性质如表.
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
A | ﹣11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
B | 17.9 | 290 | 1.26 |
据此分析,将A和B分离的常用方法是( )
A.蒸馏
B.分液
C.过滤
D.蒸发
【题目】下表是元素周期表中的一部分,根据①~⑨在周期表中的位置,用元素符号或化学式回答下列问题:
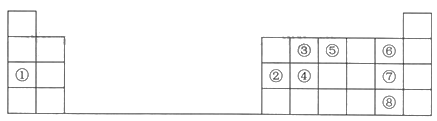
(1)元素④在元素周期表中的位置为________。
(2)最高价氧化物的水化物中碱性最强的物质的电子式为________。
(3)写出②和⑦两种元素的最高价氧化物的水化物相互反应的化学方程式:_______。
(4)④、⑤、⑥三种元素按原子半径由大到小的顺序排列为_______。
(5)③和⑦两种元素形成的简单化合物的结构式为_______,空间构型为________。
(6)设计实验探究⑦、⑧两种元素非金属性的相对强弱。
可选用的试剂有:氯水、NaBr溶液、AgNO3溶液、苯。
请完成实验报告单。
步骤一 | 步骤二 | |
实验内容 | 试管1:取少量氯水; 试管2:取少量氯水,滴加少量NaBr溶液。 | 分别向试管1、试管2中加少量______(填试剂),振荡,静置。 |
实验现象 | 试管2中的现象是______。 | 试管2中的现象是_______。 |
实验分析 | 试管1的作用是_____。 | 试管2中反应的离子方程式为_____,此实验的结论是_____。 |