题目内容
【题目】锰的合金及其化合物在现代生产、生活中有着广泛的应用。如二氧化锰是重要的氧化剂、催化剂、干电池中的去极剂;硫酸锰是重要的微量元素肥料。
Ⅰ.某工厂以菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料联合生产二氧化锰、硫酸锰晶体的工艺流程如下图所示:
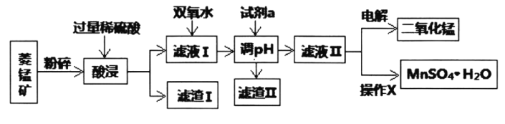
常温下几种金属氧化物沉淀时的pH:
Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时的pH | 7.2 | 2.7 | 4.7 |
完全沉淀时的pH | x | 3.7 | 6.7 |
(1)该工厂调pH时,选择试剂a的成分最好是________,滤渣Ⅱ的成分是________,操作X是________、洗涤、低温烘干。
(2)为确保除尽杂质而又不损失锰,pH调整的范围为________;若常温下离子(X)沉淀完全的标准是c(X)<1.0×10-5mol/L,Ksp[Mn(OH)2]=1.0×10-13,则使Mn2+完全沉淀时溶液的pH最小为________。
(3)若滤液Ⅱ显酸性,请写出电解法制备MnO2时阳极上的电极反应式:________。
Ⅱ.50.7g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化曲线)如下图所示。(已知:M(Mn)=55g/mol)
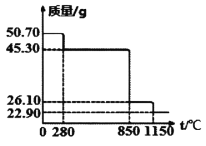
(1)850℃时,所得固体的化学式为:________________________。
(2)1150℃时,反应的化学方程式为:________________________。
【答案】MnCO3 Fe(OH)3 、Cu(OH)2 蒸发浓缩,冷却结晶,过滤 6.7≤pH<7.2 10.0 Mn2++2H2O-2e-=MnO2+4H+ MnO2 3MnO2![]() Mn2O4+O2
Mn2O4+O2![]()
【解析】
Ⅰ.菱锰矿用盐酸酸浸,MnCO3、FeCO3、Cu2(OH)2CO3与盐酸反应,SiO2不与盐酸反应,过滤得到滤渣1为SiO2,滤液1中含有氯化镁、氯化亚铁、氯化铜及剩余的HCl,向滤液中加入试剂双氧水,将溶液中Fe2+氧化为Fe3+,加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,过滤除去,滤液2中加入试剂硫酸和氯酸钾,3MnSO4+KClO3+3H2O=3H2SO4+3MnO2↓+KCl,根据电解原理进行回答判断.
Ⅱ.根据质量守恒和原子守恒计算判断;根据锰、氧元素质量守恒分析产物,书写1150℃时,反应的化学方程式。
(1)调pH时,该试剂可与氢离子反应,且不引入新的杂质,所以可用MnCO3;加入试剂a为碳酸锰、Mn(OH)2等调节PH=4时Fe3+转化为Fe(OH)3沉淀,铜离子转化为氢氧化铜沉淀,滤渣Ⅱ的成分是Cu(OH)2、Fe(OH)3;滤液Ⅱ经蒸发浓缩,冷却结晶,过滤洗涤、低温烘干后的到硫酸锰晶体;
故答案为:MnCO3;Fe(OH)3 、Cu(OH)2;蒸发浓缩,冷却结晶,过滤;
(2)为确保除尽铁离子、铜离子杂质而又不损失锰,根据图表可知pH的调整范围为:6.7≤pH<7.2;设Mn2+完全沉淀时溶液中成c(OH-)=amol/L,根据Ksp的定义可知此时a2×10-5=1.0×10-13,解得a=10-4mol/L,即pH=10,
故答案为:6.7≤pH<7.2;10.0;
(3)用电解法制备MnO2时,阳极上发生失电子的氧化反应,其电极反应式为:Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
Ⅱ.(1)50.70gMnSO4H2O样品n(锰)=n(MnSO4H2O)=0.3mol,其中n(H2O)=0.3mol,m(H2O)=5.4g,280℃时,所得固体质量为45.30g,减少的质量为5.4g,则说明该段失去结晶水,此时固体为:MnSO4,继续受热分解生成锰的氧化物和硫的氧化物0.3mol,850℃时,固体质量由45.30g减少到为26.10g,减少的质量为19.2g,则硫氧化物的相对质量为64,故为二氧化硫,则此时的固体为MnO2,
故答案为:MnO2;
(2)1150℃时固体为为二氧化锰分解所得,锰元素质量守恒,则m(锰)=n(锰)×55=16.50g,则氧化物中m(O)=22.90g-16.50g=6.4g,n(O)=0.4mol,故n(Mn):n(O)=0.3:0.4=3:4,则该氧化物为:Mn3O4,故反应为: 3MnO2![]() Mn2O4+O2
Mn2O4+O2![]() ,
,
故答案为:3MnO2![]() Mn2O4+O2
Mn2O4+O2![]() 。
。

【题目】现有7瓶失去标签的试剂瓶,已知它们盛装的液体可能是乙醇、乙酸、苯、乙酸乙酯、油脂、葡萄糖溶液、蔗糖溶液。现通过如下实验来确定各试剂中所装液体的名称。
实验步骤和方法 | 实验现象 |
①把7瓶液体依次标号为A、B、C、D、E、F、G后闻气味 | 只有F、G两种液体没有气味 |
②各取少量于试管中加水稀释 | 只有C、D、E三种液体不溶解而浮在水上层 |
③分别取少量7种液体于试管中加新制的 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
④各取C、D、E少量于试管中,加稀 | 只有C中仍有分层现象,且在D的试管中闻到特殊香味 |
(1)试写出下列序号代表的液体名称:
A________,B________,C_______,D_______,E______,F______,G________。
(2)写出在D中加入![]() 溶液并加热的化学方程式:_______。
溶液并加热的化学方程式:_______。
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D