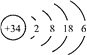
题目内容
【题目】X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如下(部分生成物已略去)。
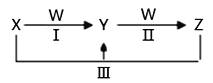
(1)若X是烧碱,Z是小苏打。
① W的分子式是____________________。
② 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
(2)若X是氯气、Z是氯化亚铁。
① 在水溶液中,反应Ⅲ的离子方程式是_________________________________。
② Y可作净水剂,其原理是_________________________(用离子方程式表示)。在使用时发现Y不能使酸性废水中的悬浮物沉降除去,其原因是__________。
【答案】 CO2 OH—+HCO3— =CO32—+H2O 2Fe2++Cl2 =2Fe3++2Cl— Fe3++3H2O![]() Fe(OH)3+3H+ 酸性溶液中较多的H+抑制Fe3+水解
Fe(OH)3+3H+ 酸性溶液中较多的H+抑制Fe3+水解
【解析】(1) 若X是烧碱,X为NaOH,Z是小苏打,Z为NaHCO3,则W为CO2,Y为Na2CO3。
①由以上分析可知W为CO2,故答案为:CO2;
②反应Ⅲ为氢氧化钠和碳酸氢钠反应生成碳酸钠和水,该反应的离子方程式为HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(2) 若X是氯气(Cl2)、Z是氯化亚铁(FeCl2),则W为铁(Fe),Y为氯化铁(FeCl3)。
①反应Ⅲ为FeCl2和Cl2的反应,反应的离子方程式是Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
②FeCl3可以净水,原因是Fe3+水解生成具有吸附性的Fe(OH)3胶体,反应的离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+,使用时发现Y不能使酸性废水中的悬浮物沉降除去,是因酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,故答案为:Fe3++3H2O
Fe(OH)3(胶体)+3H+,使用时发现Y不能使酸性废水中的悬浮物沉降除去,是因酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体,故答案为:Fe3++3H2O![]() Fe(OH)3+3H+;酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体。
Fe(OH)3+3H+;酸性条件抑制了Fe3+的水解,不能生成Fe(OH)3胶体。