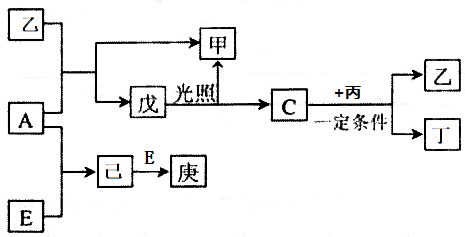
题目内容
下列有关溶液中离子浓度的关系,不正确的是( )
| A、NaHC03溶液中存在:c(OH-)=c(H2CO3)+c(H+) |
| B、常温下,pH=3的盐酸和pH=ll的氨水等体积混合后,溶液中:c(NH4+)>c(Cl-) |
| C、0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中:c(NH4+)>c(Na+) |
| D、相同温度下,0.2mol/L的CH3COOH溶液中c(H+)小于0.1mol/L的CH3COOH中c(H+)的两倍 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在电荷守恒和物料守恒;
B.常温下,pH=3的盐酸和pH=11的氨水,氨水浓度大于盐酸,二者等体积混合,溶液呈碱性,再结合电荷守恒判断;
C.0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性;
D.相同温度下,醋酸的浓度越大,其电离程度越小.
B.常温下,pH=3的盐酸和pH=11的氨水,氨水浓度大于盐酸,二者等体积混合,溶液呈碱性,再结合电荷守恒判断;
C.0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性;
D.相同温度下,醋酸的浓度越大,其电离程度越小.
解答:
解:A.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-),根据物料守恒得c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),所以得c(H2CO3)+c(H+)=c(OH-)+c(CO32-),故A错误;
B.常温下,pH=3的盐酸和pH=11的氨水,氨水浓度大于盐酸,二者等体积混合氨水有剩余,溶液呈碱性,再结合电荷守恒得c(NH4+)>c(Cl-),故B正确;
C.0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性,钠离子不水解,则c(NH4+)>c(Na+),故C正确;
D.相同温度下,醋酸的浓度越大,其电离程度越小,所以0.2mol/L的CH3COOH溶液中c(H+)小于0.1mol/L的CH3COOH中c(H+)的两倍,故D正确;
故选A.
B.常温下,pH=3的盐酸和pH=11的氨水,氨水浓度大于盐酸,二者等体积混合氨水有剩余,溶液呈碱性,再结合电荷守恒得c(NH4+)>c(Cl-),故B正确;
C.0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后,溶液中的溶质是等物质的量浓度的NH4Cl、NH3.H2O、NaCl,一水合氨电离程度大于铵根离子水解程度,导致溶液呈碱性,钠离子不水解,则c(NH4+)>c(Na+),故C正确;
D.相同温度下,醋酸的浓度越大,其电离程度越小,所以0.2mol/L的CH3COOH溶液中c(H+)小于0.1mol/L的CH3COOH中c(H+)的两倍,故D正确;
故选A.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质,再结合守恒思想分析解答,注意碳酸钠和碳酸氢钠中质子守恒不同,为易错点.

练习册系列答案
相关题目
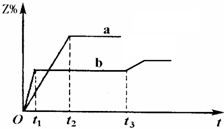 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g)?3Z(g).Z的含量(Z%)随时间t的变化如图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )| A、曲线a是500℃时的图象 |
| B、t3时刻可能是降低了温度 |
| C、正反应是吸热反应 |
| D、t3时刻可能是增大了压强 |
25℃时,在1.0L浓度均为0.01mol?L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
| A、该溶液的pH<7 |
| B、c(A-)+c(HA)═0.02mol?L-1 |
| C、n(A-)+n(OH-)═0.01mol+n(H+) |
| D、HA的酸性很弱,A-的水解程度大于HA的电离程度 |
邻苯二甲醛(D)在碱性条件下发生歧化(即自身氧化还原)反应,再经酸化得到化合物E.E可在浓硫酸存在的条件下生成含五元环的化合物F.下列说法正确的是( )
| A、邻二甲苯可作生产D的原料 |
| B、E可发生银镜反应 |
| C、E可与FeCl3发生显色反应 |
| D、F与D的相对分子质量相等 |
下列离子方程式正确的是( )
A、用石墨作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ | ||||
| C、Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | ||||
| D、AlCl3溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
某软质隐形眼镜材料为如图所示的聚合物.下列有关说法错误的是( )
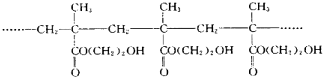

| A、生成该聚合物的反应属于加聚反应 |
| B、该聚合物的单体是丙酸乙酯 |
| C、该聚合物分子中存在大量的-OH,所以具有较好的亲水性 |
D、该聚合物的结构筒式为: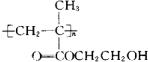 |
 材料是人类赖以生存与发展的重要物质基础,是时代进步的重要标志.
材料是人类赖以生存与发展的重要物质基础,是时代进步的重要标志.