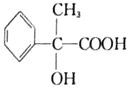
题目内容
【题目】控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题。

(1)化学反应速率本质上是由_____________ 决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3表明_____________ 对反应速率有影响,该因素对反应速率的具体影响是其他条件相同时,_____________反应速率越快。
(2)我们选取实验_____________(填实验序号)研究锌的形状对反应速率的影响。我们发现在其他条件相同时,反应物间的_____________反应速率越快。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少硫酸铜溶液,发现反应速率明显加快,原因是 _____________。
(4)利用表中数据,可以求出硫酸的物质的量浓度是_____________![]() (计算结果精确到小数点后一位)。
(计算结果精确到小数点后一位)。
【答案】反应物本身的性质 温度 温度越高 1、2和4 接触面积越大 锌会置换出少量的金属铜,在该条件下构成了原电池,加快了反应速率 2.0
【解析】
(1)化学反应速率本质上是由反应物本身的性质决定的;实验2和实验3中,除了温度不同外,其他条件完全相同,则说明探究的是温度对反应速率的影响,即温度越高反应速率越快;
(2)根据表中数据可知,实验1、2和4中,除了锌的形状不同外,其他条件完全相同,则它们是探究锌的形状对反应速率的影响,即反应物间的接触面积越大反应速率越快;
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,由于锌会置换出少量的金属铜,在该条件下构成了原电池,所以反应速率明显加快;
(4)根据实验6和实验7可知,加入8.0g锌与加入10.0g锌生成的硫酸锌质量相同,说明两个实验中硫酸完全反应,16.1g硫酸锌的物质的量为![]() ,则原硫酸的物质的量浓度为
,则原硫酸的物质的量浓度为![]() 。
。

【题目】硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、![]() 、FeO、
、FeO、![]() ,、
,、![]() 等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取
等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取![]() 的工艺流程如下:
的工艺流程如下:
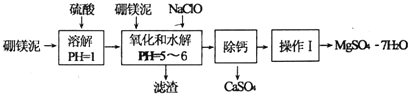
已知:NaClO与![]() 反应产生
反应产生![]() 沉淀.
沉淀.
沉淀物 |
|
|
|
开始沉淀pH |
|
|
|
完全沉淀pH |
|
|
|
![]() 实验中需用
实验中需用![]() 的硫酸
的硫酸![]() 若用
若用![]() 的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 ______ .
![]() 滤渣的主要成分除含有
滤渣的主要成分除含有![]() 、
、![]() 外,还有 ______ .
外,还有 ______ .
![]() “操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
“操作I”的主要操作为蒸发浓缩、冷却结晶、 ______ .
![]() 写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
写出加入NaClO时,溶液中氧化还原反应的离子方程式 ______ 、 ______ .
![]() 已知:溶液的
已知:溶液的![]() 时,铝元素有多种存在形态,如
时,铝元素有多种存在形态,如![]() 、
、![]() 、
、![]() 等,各形态之间可相互转化,写出该溶液中
等,各形态之间可相互转化,写出该溶液中![]() 转化为
转化为![]() 的离子方程式 ______ ;
的离子方程式 ______ ;
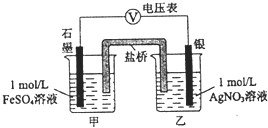
![]() 某同学为探究
某同学为探究![]() 和
和![]() 反应,按如图连接装置并加入药品
反应,按如图连接装置并加入药品![]() 盐桥中的物质不参与反应
盐桥中的物质不参与反应![]() ,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓
,发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓![]() 溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极
溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为 ______ 极![]() 填“正”或“负”
填“正”或“负”![]() 由实验得出
由实验得出![]() 和
和![]() 反应的离子方程式是 ______
反应的离子方程式是 ______