题目内容
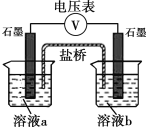
【题目】某同学设计如下原电池,其工作原理如图所示。下列说法不正确的是
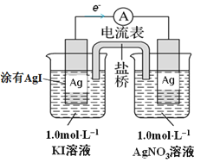
A. 该装置将化学能转化为电能
B. 负极的电极反应是:Ag +I--e-=AgI
C. 电池的总反应是Ag+ +I-=AgI
D. 盐桥(含KNO3的琼脂)中NO3-从左向右移动
【答案】D
【解析】
图中没有外接电源,反而是有个电流表,且电路中有电子的移动方向,则该装置是原电池装置。由于只有Ag+能和I-离子反应,所以电池的总反应是Ag+ +I-=AgI,负极反应为:Ag +I--e-=AgI,正极反应为:Ag++e-=Ag。
A. 经分析,该装置是原电池装置,则该装置将化学能转化为电能,A正确;
B. 根据电子的移动方向,可以推断出左侧电极为负极,该电极反应为:Ag +I--e-=AgI,B正确;
C. 该电池中,表观上看,只有Ag+和I-反应,所以总反应是Ag+ +I-=AgI,C正确;
D. 左侧电极为负极,右侧电极为正极,NO3-带负电荷,向负极移动,所以应该是从右向左移动,D错误;
故合理选项为D。

【题目】实验小组同学探究稀H2SO4对溶液中的I—被O2 氧化的影响因素。
(1)为了探究c(H+)对反应速率的影响,进行实验:
10mL 1mol· L-1 KI溶液5滴淀粉溶液 | 序号 | 加入试剂 | 变色时间 |
Ⅰ | 10mL蒸馏水 | 长时间放置,未见明显变化 | |
Ⅱ | 10mL 0.1mol· L-1H2SO4溶液 | 放置3min后,溶液变蓝 | |
Ⅲ | 10mL 0.2mol· L-1H2SO4溶液 | 放置1min后,溶液变蓝 | |
Ⅳ | 10mL 0.1mol· L-1K2SO4溶液 | 长时间放置,未见明显变化 |
① 写出实验Ⅱ发生反应的离子方程式 ______。
② 实验Ⅰ~Ⅲ所得结论:_______。
③ 增大实验Ⅱ反应速率还可以采取的措施 ______。
④ 实验Ⅳ的作用是______。
(2)为探究c(H+)除了对反应速率影响外,是否还有其他影响,提出假设:
ⅰ. 增大c(H+),增强O2的氧化性;
ⅱ. 增大c(H+),_______。
小组同学利用下图装置设计实验方案,对假设进行验证。
| 序号 | 溶液a | 溶液b | 现象 |
Ⅴ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 | |
Ⅵ | 10mL 1mol· L-1 KI溶液 10mL H2O | 10mL 0.1mol·L-1K2SO4溶液 1mL 0.2mol·L-1H2SO4溶液 9mL H2O | 指针 偏转 | |
Ⅶ | X | 10mL 0.1mol·L-1K2SO4溶液 10mL 0.2mol·L-1H2SO4溶液 | Y | |
Ⅷ | Z | 10mL 0.1mol·L-1K2SO4溶液 10mLH2O | 指针未见偏转 |
通过实验证实假设ⅰ合理,将表中空白处的试剂或现象补充完整。
X __________;Y _________;Z __________。