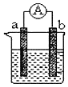
题目内容
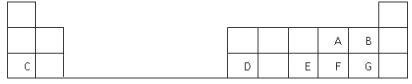
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
【答案】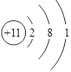 ⅢAPH3H2SO4
ⅢAPH3H2SO4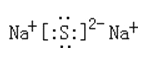 O2->Na+>Mg2+
O2->Na+>Mg2+
【解析】
根据元素在周期表中的相对位置判断出元素,然后结合元素周期律以及相关物质的性质分析解答。
根据元素在周期表中的位置可知A~G分别是O、F、Na、Al、P、S、Cl。则
(1)钠是原子序数是11,原子结构示意图为 。
。
(2)铝元素在元素周期表中的位置是第三周期第ⅢA族。
(3)非金属性越强,氢化物越稳定。A、B、E、F、G五种元素的非金属性强弱顺序是F>O>Cl>S>P,则所形成的气态氢化物中最不稳定的是PH3。
(4)非金属性越强,最高价含氧酸的酸性越强,则根据以上分析可知E、F元素的最高价氧化物对应水化物的酸性较强的是H2SO4。
(5)C和F形成的化合物是含有离子键的离子化合物硫化钠,电子式为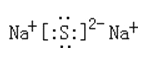 。
。
(6)离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A、C、D的简单离子半径大小关系是O2->Na+>Mg2+。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目