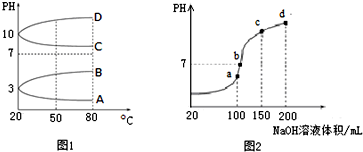
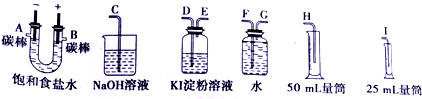
题目内容
17.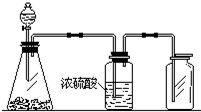 如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )
如图是一套实验制取气体的装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是( )| A. | 制取NO气体 | B. | 制取二氧化碳气体 | ||
| C. | 制取氯气 | D. | 制取氨气 |
分析 由装置图可知,反应为液体和固体的反应,且不需要加热,生成的气体可用浓硫酸干燥,且能用向上排空法收集,说明气体的密度比空气大,不与空气中氧气发生反应,以此解答该题.
解答 解:A.铜和稀硝酸反应生成的NO密度和空气非常接近,难溶于水,与空气中的氧气反应,所以只能用排水法收集,故A错误;
B.大理石和稀盐酸反应生成二氧化碳,二氧化碳密度比空气大,可用向上排空法收集,故B正确;
C.高锰酸钾和浓盐酸应在不加热的条件下反应,生成氯气有毒,需要尾气吸收,故C错误;
D.氨气密度比空气小,应用向下排空法收集,且不能用浓硫酸干燥,故D错误;
故选B.
点评 本题考查气体的制备和收集,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握物质的性质,根据性质判断装置的要求,难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
5.(1)胆矾CuSO4•5H2O的结构示意图1如下,其含有的微粒间作用力有abde(填序号)
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(2)根据等电子原理,写出与CO2等电子体的分子和离子各一种N2O或CS2、CNO-或SCN-或NO2+;1molO22+中含有的π键数目为2NA
(3)已知
分析表中四种物质的相关数据,请回答
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
(4)C60形成晶体的晶胞结构如图2所示,则每个C60分子周围距离最近的C60分子由12个,若晶胞参数为pnm,列出计算该晶体的密度$\frac{4×720}{(p×1{0}^{-7})^{3}{N}_{A}}$g•cm-3(阿伏伽德罗常数用NA表示)
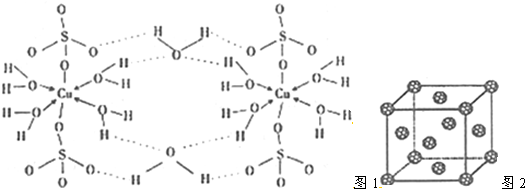
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(2)根据等电子原理,写出与CO2等电子体的分子和离子各一种N2O或CS2、CNO-或SCN-或NO2+;1molO22+中含有的π键数目为2NA
(3)已知
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是结构相似时,相对分子质量越大,分子间作用力越大,因此CH4的沸点低于SiH4;但氨气分子间还存在氢键,则NH3的沸点高于PH3
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是C-H键的键能大于Si-H键的键能,N-H键的键能大于P-H键的键能,因此分解温度CH4的分解温度高于SiH4,NH3的分解温度高于PH3
(4)C60形成晶体的晶胞结构如图2所示,则每个C60分子周围距离最近的C60分子由12个,若晶胞参数为pnm,列出计算该晶体的密度$\frac{4×720}{(p×1{0}^{-7})^{3}{N}_{A}}$g•cm-3(阿伏伽德罗常数用NA表示)

9.关于下列装置的叙述正确的是( )
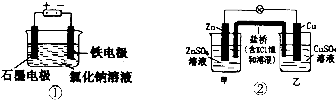

| A. | 装罝①两极均有气泡产生,滴人酚酞溶液后,石墨电极附近溶液变红 | |
| B. | 装置①电解一段时间,加人盐酸溶液可使电解质溶液恢复原状 | |
| C. | 装置②盐桥中的K+向乙池移动 | |
| D. | 装置②反应一段时间后,乙池中溶液的pH变小 |
6.下列化学用语正确的是( )
| A. | 聚乙烯的结构简式: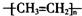 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
7.汽车尾气的转化反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g),若反应在容积为0.5L的密闭容器中进行,由该反应相关图象作出的判断正确的是( )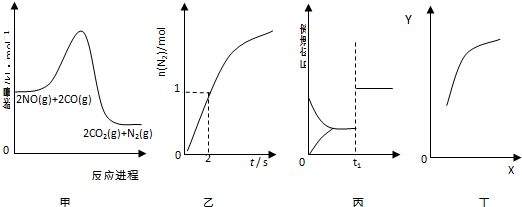

| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |