题目内容
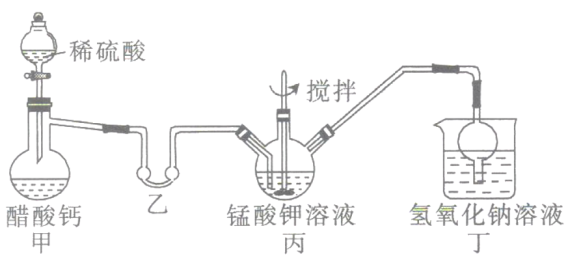
【题目】以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
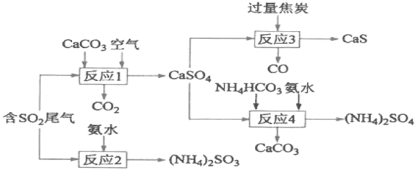
(1)反应1的化学方程式为________________;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________;
(4)整个合成路线中可以循环利用的物质是_____________;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________。
【答案】2CaCO3+O2+2SO2===2CaSO4+2CO2 2NH3H2O+SO2==![]() +
+![]() +H2O CO-2e-+
+H2O CO-2e-+![]() ===2CO2 CaCO3 448L
===2CO2 CaCO3 448L
【解析】
反应1中二氧化硫与碳酸钙、空气中的氧气反应生成硫酸钙,硫元素化合价发生变化,故发生氧化还原反应;反应2中二氧化硫与一水合氨反应生成亚硫酸铵;反应3中硫酸钙与过量焦炭发生氧化还原反应生成硫化钙和一氧化碳,反应方程式为CaSO4+4C=CaS+4CO↑;反应4中硫酸钙与碳酸氢铵、氨水反应生成硫酸铵和碳酸钙,反应方程式为CaSO4+NH4HCO3+NH3![]() H2O=CaCO3+(NH4)2SO4。
H2O=CaCO3+(NH4)2SO4。
(1)反应1中碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2。
(2)反应2中用足量氨水吸收SO2,反应生成亚硫酸铵,故该反应的离子方程式为2NH3H2O+SO2==![]() +
+![]() +H2O。
+H2O。
(3)燃料电池中CO通入负极发生氧化反应,碳元素失电子,化合价升高生成碳酸根离子,则负极电极反应式为CO-2e-+![]() ===2CO2。
===2CO2。
(4)反应1中碳酸钙作为反应物,而反应4中又生成碳酸钙,故碳酸钙可以循环利用。
(5)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,故一氧化氮与亚硫酸铵反应,生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为2(NH4)2SO3+2NO=2(NH4)2SO4+N2,10.00L 2.00mol/L的(NH4)2SO3溶液中,n[(NH4)2SO3]= 10.00L![]() 2.00mol/L=20mol,n[(NH4)2SO3]:n(NO)=1:1,则n(NO)=20mol,则标准状况下NO气体的体积V=20mol
2.00mol/L=20mol,n[(NH4)2SO3]:n(NO)=1:1,则n(NO)=20mol,则标准状况下NO气体的体积V=20mol![]() 22.4L/mol=448L。
22.4L/mol=448L。

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】根据所给的实验装置,下列有关实验的相关叙述正确的是
选项 | 实验装置 | 相关叙述 |
A |
| 实验室可以用该装置和药品制取氨气 |
B |
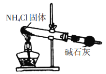
| 反应过程中,温度降低,Ba(OH)2·8H2O与NH4Cl反应是吸热反应 |
C |
| ①中反应比②中快,说明温度升高可以加快反应速率 |
D |
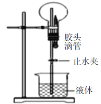
| 只有氨气等极易溶于水的气体才能利用该装置形成喷泉 |
A.AB.BC.CD.D