��Ŀ����
����Ŀ�����ϣ�� 19 ���������������гɹ��Ļ�ѧ�ҡ����Ĺ���֮һ���Ƿ�����ȼ�շ��ⶨ�л��ﻯѧ��ɡ�
��.ij������ȫȼ�պ����ɶ�����̼��ˮ����ȡ 3.0g �������������ϣ��������ɲⶨ����ˮ�Ȼ������� 1.8g��Ũ����������Һ���� 4.4g��������ʵ����ʽΪ_________________��
��.�������ʷ��ϴ����ʽ����Ҫȷ����������ʣ����踨�������IJ����ֶΡ�
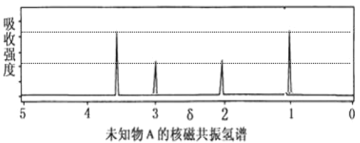
(1)������ A ������ͼ��ͼ��ʾ��
���� A ����Է�������Ϊ_____________________��
������ A ���뵽��ɫʯ����Һ�б�죬�� A �Ľṹ��ʽΪ________________��
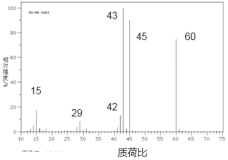
(2)���ⶨ���� B �������ܶ�����ͬ״���� H2 �� 45 ��
���� B �ķ���ʽΪ__________________��
�ڲⶨ B �ĺ������ͼ�� C=O ����O��H �������Գ���CH2���ȵ������շ壬��˴Ź���������ͼ��ʾ��B �Ľṹ��ʽΪ_________________��
��ȡһ������B����ƽ���ֳ�2�ݣ�һ����������NaHCO3���ã�һ����������Na���ã��������CO2��H2�������Ϊ___��
(3)���ⶨ C ���ʵ���Է�������Ϊ 180���� C Ϊ����ˮ������ղ��������һ�������£� C ���������� A ���ʷ�������ת����ϵ��
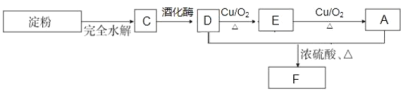
����д�� D ��� E �Ļ�ѧ����ʽ___________________��
����֪ G ����Ϊ D ���ʵ�ͬϵ���Է��������� D �� 14������˴Ź���H����ʾ 3 ��壬�����Ϊ 6��1��1����д�� G �� A ����������Ӧ�ķ���ʽ____________��
��.�ֱ�����������A��B��C����������������������Ӧ������ʵ���������������ʵ���֮��Ϊ____��
���𰸡�CH2O 60 CH3COOH C3H6O3 CH2(OH)CH2COOH 1:1 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3CH(OH)CH3+CH3COOH
2CH3CHO+2H2O CH3CH(OH)CH3+CH3COOH![]() CH3COOCH(CH3)2+ H2O 1:1:1
CH3COOCH(CH3)2+ H2O 1:1:1
��������
��.���ݸ�����ȼ�����ɵĶ�����̼��ˮ�������ֱ����C��HԪ�ص����ʵ������������ٽ�ϸ����ʵ������ж�����OԪ�أ��������ʵ������Ӷ�ȷ�����ʽ��
��.(1)����A ����Է������������ʽȷ������ʽ���ٸ���������ȷ����ṹ��ʽ��
(2)�ٸ��ݰ����ӵ����ɵ�����ȷ��B����Է����������ٽ�����ʽȷ������ʽ��
�ڸ���B�ĺ������ͼȷ���Ļ�ѧ�����������Ϣ�Լ���˴Ź�������ȷ��B�Ľṹ��ʽ��
�۸���CH2(OH)CH2COOH�ֱ���NaHCO3��Na��Ӧ���ص���з�����
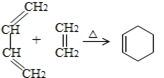
(3)����C���ʵ���Է������������ʽȷ������ʽ���ٸ���CΪ����ˮ������ղ��ȷ��CΪ�����ǣ��������ھƻ�ø������������DΪ�Ҵ�CH3CH2OH���Ҵ���������������EΪ��ȩCH3CHO����ȩ��������������AΪ����CH3COOH���Ҵ������ᷢ��������Ӧ����FΪ��������CH3COOCH2CH3���ݴ˷������
��.���ʽ��ͬ���л���������ȣ���ȫȼ�պ�������ȡ�
��.ij������ȫȼ�պ����ɶ�����̼��ˮ����������һ������C��HԪ�أ����ܺ���OԪ�أ���ȡ 3.0g �������������ϣ��������ɲⶨ����ˮ�Ȼ������� 1.8g����![]() ��n(H)=0.2mol��m(H)=0.2g����Ũ����������Һ����4.4g����
��n(H)=0.2mol��m(H)=0.2g����Ũ����������Һ����4.4g����![]() ��n(C)=0.1mol��m(C)=1.2g����m(O)=3.0g- m(H)- m(C)=3.0g-0.2g-1.2g=1.6g��
��n(C)=0.1mol��m(C)=1.2g����m(O)=3.0g- m(H)- m(C)=3.0g-0.2g-1.2g=1.6g��![]() ����n(C)��n(H)��n(O)=0.1mol��0.2mol��0.1mol=1:2:1��������ʵ����ʽΪCH2O��
����n(C)��n(H)��n(O)=0.1mol��0.2mol��0.1mol=1:2:1��������ʵ����ʽΪCH2O��
��.(1)�������� A ������ͼ��֪ A ����Է�������Ϊ60��
��A ����Է�������Ϊ60�����ʽΪCH2O(ʽ��Ϊ30)�������ʽΪC2H4O2������ A ���뵽��ɫʯ����Һ�б�죬��A�к����Ȼ���AӦΪ���ᣬ�� A �Ľṹ��ʽΪCH3COOH��
(2)����ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Ħ������֮�ȿ�֪�����ⶨ���� B �������ܶ�����ͬ״���� H2 �� 45 ������B����Է�������Ϊ90�����ʽΪCH2O�������ʽΪC3H6O3��
�ڲⶨ B �ĺ������ͼ�� C=O ����O��H �������Գ���CH2���ȵ������շ壬����˴Ź�������֪��B�к���4�ֵ�Ч��ԭ�ӣ��Ҹ�����Ϊ2:2:1:1����B�Ľṹ��ʽΪCH2(OH)CH2COOH��
��CH2(OH)CH2COOH���Ȼ�������NaHCO3��Ӧ����CO2���ҷ��Ϲ�ϵʽCH2(OH)CH2COOH~CO2���ǻ����Ȼ���������Na��Ӧ�����������ҷ��Ϲ�ϵʽCH2(OH)CH2COOH~H2����ȡһ������B����ƽ���ֳ�2�ݣ�һ����������NaHCO3���ã�һ����������Na���ã�������CO2��H2�������Ϊ1:1��
(3)���ⶨ C ���ʵ���Է�������Ϊ180�����ʽΪCH2O�������ʽΪC6H12O6���� C Ϊ����ˮ������ղ����CΪ�����ǣ��������ھƻ�ø������������DΪ�Ҵ�CH3CH2OH���Ҵ���������������EΪ��ȩCH3CHO����ȩ��������������AΪ����CH3COOH���Ҵ������ᷢ��������Ӧ����FΪ��������CH3COOCH2CH3��
���Ҵ�����������������ȩ����Ӧ�Ļ�ѧ����ʽΪ2CH3CH2OH+O2![]() 2CH3CHO+2H2O��
2CH3CHO+2H2O��
����֪ G ����Ϊ D ���ʵ�ͬϵ���Է��������� D �� 14����GΪ����������˴Ź���H����ʾ 3 ��壬�����Ϊ 6��1��1����GΪ2-�������ṹ��ʽΪCH3CH(OH)CH3������CH3COOH����������Ӧ�Ļ�ѧ����ʽΪCH3CH(OH)CH3+CH3COOH![]() CH3COOCH(CH3)2+ H2O��
CH3COOCH(CH3)2+ H2O��
��.��ΪA��B��C�����ʽ��ͬ�����������A��B��C�����е�C��H��OԪ�ص�������ȣ���ֱ�����������A��B��C����������������������Ӧ������ʵ���������������ʵ�����ȣ�����ֵΪ1:1:1��

 ����������������ϵ�д�
����������������ϵ�д�����Ŀ������ʵ������ܴﵽʵ��Ŀ�ĵ���
ѡ�� | ʵ��Ŀ�� | ʵ����� |
A | ��ȥNaHCO3�����л��е�NH4HCO3 | ֱ�ӽ�������� |
B | ʵ�����ռ�NO2���� | ����ˮ�������ռ� |
C | ����ǽ�����Cl>C | ��Na2CO3��Һ�м�������HCl |
D | ����ij��Һ���Ƿ��� | ȡ����Һ���Թ��У�����NaOH��Һ����ȣ���ʪ��ĺ�ɫʯ����ֽ���� |
A.AB.BC.CD.D
����Ŀ��Ԫ�����ڱ���Ԫ����������ѧϰ���о�������ʵ��������Ҫ�����á��±��г�����ʮ��Ԫ�������ڱ��е�λ�á�
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� | �� |
(1)��~���н�������ǿ��Ԫ��Ϊ____________(д���ƣ���
(2)�١�������Ԫ���γɵĻ�����ڸ��������գ������____________ɫ��
(3)�ߡ�������Ԫ�ص�����������Ӧˮ��������Խ�ǿ����____________(�ѧʽ����
(4)�١��ޡ��ࡢ������Ԫ���γɵļ����Ӱ뾶�ɴ�С��˳��������____________span>����������������ʾ��
(5)��Ԫ�ص��⻯��ʵ�����Ʒ��Ļ�ѧ����ʽ��____________��
(6)�ݡ������̬�⻯���ڿ����������а������ɣ�д�����̶�Ӧ���ʵĵ���ʽ____________��
(7)����˵����ȷ����____________(����ĸ����
a���ķǽ�����ǿ�ڢ� b���⻯���ȶ������ߣ��� c���۵�����ˮ��Ӧ�ȵ��ʢپ���