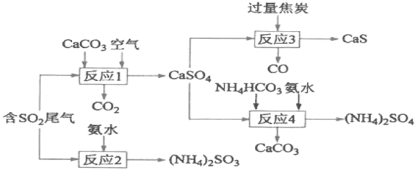
题目内容
【题目】硼、铁、镍及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态铁原子的外围电子排布式为__________。
(2)NaBH4、LiBH4常作有机合成的还原剂。LiBH4中B原子的杂化方式为________;BH4-的空间构型为____________。
(3)NiO、FeO的晶体类型相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm。熔点:FeO_____NiO(填“>”、“<”或“=”),理由是____________。
(4)镍能形成多种配合物,如Ni(CO)4、[Ni(NH3)6]2+等。[Ni(NH3)6]2+中,Ni2+的配位数为_________;在Ni(CO)4中提供孤电子对的原子是C,不是O,可能的原因是_________。
(5)氧化镍晶胞如图所示,镍离子的配位数为__________。已知晶胞参数为a cm,NA为阿伏加德罗常数的值,则氧化镍晶体密度为__________g·cm-3。
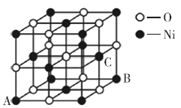
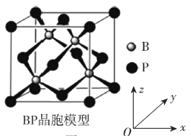
(6)磷化硼晶体结构类似金刚石,是一种耐磨材料,常作金属涂层,其晶胞如图所示。磷化硼晶胞沿z轴的平面投影图中,B原子构成的几何形状是__________。
【答案】3d64s2 sp3 正四面体 < NiO、FeO均为离子晶体,O2-相同,阳离子所带电荷数相同,Ni2+半径较小,NiO的晶格能较大,熔点较高 6 氧的电负性大于碳,提供孤对电子的能力比碳弱 6 ![]() 正方形
正方形
【解析】
铁的核外电子数为26;B原子与4个H原子形成4个σ键;分子的晶格能越大,熔点越高。
(1)Fe为26号元素,原子核外有26个电子,外围电子排布式为3d64s2。
(2)B原子价层电子对个数=![]() 且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化方式为sp3,BH4-的空间构型为正四面体。
且不含孤电子对,根据价层电子对互斥理论判断B原子的杂化方式为sp3,BH4-的空间构型为正四面体。
(3)NiO、FeO均为离子晶体,离子半径越小,离子所带电荷越多,晶格能越大,熔点越高。Ni2+、Fe2+所带电荷数相同,已知Ni2+、Fe2+的半径分别为72 pm、76 pm,离子半径:Ni2+<Fe2+,晶格能NiO>FeO,故熔点:FeO<NiO(填“>”、“”或“=”)。
(4)[Ni(NH3)6]2+中,Ni2+的配位数为6;在Ni(CO)4中,氧的电负性大于碳,C对孤电子吸引力较小,易提供孤对电子。
(5)氧化镍晶胞是面心立方堆积,类似氯化钠晶胞,镍离子的配位数为6。1个晶胞中O原子的个数为![]() ,Ni原子个数为
,Ni原子个数为![]() ,故1个晶胞中含4个NiO,氧化镍晶体的密度
,故1个晶胞中含4个NiO,氧化镍晶体的密度![]() 。
。
(6)磷化硼晶胞中,P原子将晶胞分成8个小立方体,4个B原子分别位于4个互不相邻的小立方体中心,构成正四面体。故沿z轴的平面投影图中,B原子构成的几何形状是正方形。

 名校课堂系列答案
名校课堂系列答案【题目】元素周期表与元素周期律在学习、研究和生产实践中有重要的作用。下表列出①⑩十种元素在周期表中的位置。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ⑤ | ⑧ | ||||||
3 | ① | ③ | ④ | ⑥ | ⑨ | |||
4 | ② | ⑦ | ⑩ |
(1)①~⑩中金属性最强的元素为____________(写名称)。
(2)①、⑧两种元素形成的化合物,在高温下灼烧,火焰呈____________色。
(3)⑦、⑨两种元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(4)①、⑥、⑧、⑨四种元素形成的简单离子半径由大到小的顺序依次是____________span>。(用微粒符号来表示)
(5)⑤元素的氢化物实验室制法的化学方程式是____________。
(6)⑤、⑨的气态氢化物在空气中相遇有白烟生成,写出白烟对应物质的电子式____________。
(7)下列说法正确的是____________(填字母)。
a.⑥的非金属性强于⑦ b.氢化物稳定性:⑦<⑩ c.③单质与水反应比单质①剧烈
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) ![]() N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)十O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是
A.反应在0~3s内的平均速率v(NO2)=0.24 mol·L-1·s-1
B.24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol·L-1,则反应的ΔH<0
C.在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍
D.在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20%