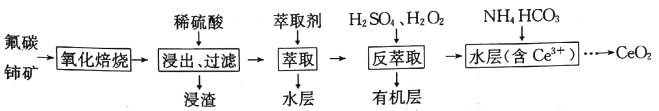
题目内容
【题目】索氏提取法是测定动植物样品中粗脂肪含量的标准方法。其原理是利用如图装置,用无水乙醚等有机溶剂连续、反复、多次萃取动植物样品中的粗脂肪。具体歩驟如下:
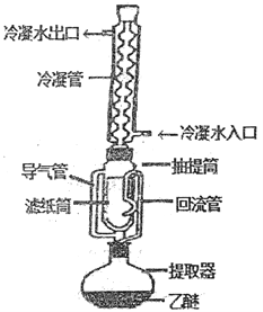
①包装:取滤纸制成滤纸管,放入烘箱中干燥后,移至仪器X中冷却至室温。然后放入称量瓶中称量,貭量记作a;在滤纸筒中包入一定质量研细的样品,放入烘箱中干燥后,移至仪器X中冷却至室温,然后放入称量瓶中称量,貭量记作b.
②萃取:将装有样品的滤纸筒用长镊子放入抽提筒中,注入一定量的无水乙醚,使滤纸筒完全浸没入乙醚中,接通冷凝水.加热并调节温度,使冷凝下滴的无水乙醚呈连珠状,至抽提筒中的无水乙醚用滤纸点滴检查无油迹为止(大约6h~12h).
③称量.萃取完毕后,用长镊子取出滤纸筒,在通风处使无水乙醚挥发后,将滤纸筒放入烘箱中干燥后,移至仪器X中冷却至室温.然后放入称量瓶中称量,貭量记作c。
回答下列问题:
(1)实验中使用了三次的仪器X的名称________。为提高乙醚蒸气的冷凝效果,索氏提取器中的冷凝管可选用下列(______)
A.空气冷凝管![]()
B.直形冷凝管![]()
C.蛇形冷凝管![]()
(2)①实验中必须十分注意乙醚的安全使用,如不能用明火加热、室内保持通风等。为防止乙醚挥发到空气中形成燃爆,常在冷凝管上口连接一个球形干燥管,其中装入的药品为____(填字母)。
A.活性炭 B.碱石灰 C.P2O5 D.浓硫酸
②无水乙醚在空气中可能氧化生成少量过氧化物,加热时发生爆炸。检验无水乙醚中是否含有过氧化物的方法是__________。
(3)①实验中需控制温度在70℃~80℃之间,考虑到安全等因素,应采取的加热方式是____。
②当无水乙醚加热沸腾后,蒸气通过导气管上升,被冷凝为液体滴入抽提管中,当液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中……该过程连续、反复、多次进行,则萃取液回流入提取器(烧瓶)的物理现象为_______。
A.冷凝回流 B.虹吸 C.倒吸 D.分液
③索氏提取法与一般萃取法相比较,其优点为______。
(4)数据处理:样品中纯脂肪百分含量____(填“>”、“<”或“=”)![]() 。
。
【答案】 干燥器 C A 取少量乙醚滴加稀硫酸和KI淀粉溶液,撤荡,若溶液变蓝色,则说明含有过氧化物,否则不含 水浴加热 B 连续、反复、多次萃取、且每一次萃取都是纯的溶剂,萃取效率高 <
【解析】(1)根据“移至仪器X中冷却至室温”判断;根据仪器构造结合提高冷凝效果判断;
(2)①根据物质的性质特点分析;
②根据过氧化物具有强氧化性分析;
(3)①根据水浴加热容易控制温度解答;
②根据虹吸是利用液面高度差的作用力现象解答;
③根据二者的萃取原理分析;
(4)根据乙醚可能溶解样品中的其它有机物分析。
(1)题中三次描述“移至仪器X中冷却至室温”,说明仪器X是干燥器;为提高乙醚蒸气的冷凝效果,索氏提取器中的冷凝管可选用C蛇形冷凝管,增大接触面积,延长冷凝时间,提高冷凝效果。
(2)①在冷凝管上口连接一个球形干燥管的目的是吸收没有冷凝的乙醚,根据这四种物质的性质,可用来吸收乙醚的只有活性炭,答案选A;
②过氧化物一般都有较强的氧化性,所以可在酸性条件下用KI淀粉来检验,方法是取少量乙醚滴加稀硫酸和KI淀粉溶液,振荡,若溶液变蓝色则说明含过氧化物,否则不含。
(3)①根据需要控制的温度低于100℃,又不能用明火加热,可进行水浴加热;
②根据实验描述,当萃取液的液面超过回流管最高处时,萃取液即回流入提取器(烧瓶)中,这是利用虹吸原理,答案选B;
③根据题干信息可知索氏提取法与一般萃取法相比较,其优点为可进行连续、反复、多次的萃取,且每一次萃取都是用纯的溶剂,萃取效率高。
(4)由于有机溶剂乙醚可能溶解样品中的其它有机物,所以纯脂肪的质量小于(b-c)g,因此样品中纯脂肪百分含量小于![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案