题目内容
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
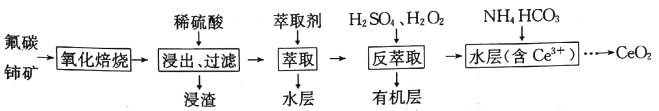 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
【答案】 矿石粉碎成细颗粒 通入大量空气 CeO2+4H++SO42-=[CeSO4]2++2H2O 随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+方向移动,D迅速减小 ![]() 2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
2Ce4++H2O2=2Ce3++O2↑+2H+ 1×10-6mol/L 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】试题分析:本题以氟碳铈矿为原料制备CeO2的流程为载体,考查流程的分析,指定情境下方程式的书写,外界条件对化学反应速率和化学平衡的影响,溶度积和平衡常数的计算。
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是:将矿石粉碎成细颗粒,增大接触面积;通入大量空气。
(2)根据题给已知“Ce4+能与SO42-结合成[CeSO4]2+”,CeO2与稀H2SO4反应的离子方程式为CeO2+4H++SO42-=[CeSO4]2++2H2O。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+,加入Na2SO4,随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,即向生成[CeSO4]2+方向移动,D迅速减小。
Ce(H2n-4A2n)+4H+,加入Na2SO4,随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,即向生成[CeSO4]2+方向移动,D迅速减小。
(4)反应Ce(BF4)3(s)+ 3K+(aq)![]() 3KBF4(s)+ Ce3+(aq)的平衡常数K=
3KBF4(s)+ Ce3+(aq)的平衡常数K=![]() =
=![]() =
=![]() =
=![]() 。
。
(5)“萃取”后的有机层中为Ce4+,根据流程,加入H2O2将Ce4+还原成Ce3+,则H2O2被氧化成O2,反应写成Ce4++H2O2→Ce3++O2↑,根据得失电子守恒配平为2Ce4++H2O2→2Ce3++O2↑,结合原子守恒、电荷守恒以及溶液呈酸性,写出离子方程式为2Ce4++H2O2=2Ce3++O2↑+2H+。Ce2(CO3)3饱和溶液的浓度为1.0![]() 10-6mol/L,Ce2(CO3)3的溶解平衡为:Ce2(CO3)3(s)
10-6mol/L,Ce2(CO3)3的溶解平衡为:Ce2(CO3)3(s)![]() 2Ce3+(aq)+3CO32-(aq),则饱和溶液中c(Ce3+)=2.0
2Ce3+(aq)+3CO32-(aq),则饱和溶液中c(Ce3+)=2.0![]() 10-6mol/L、c(CO32-)=3.0
10-6mol/L、c(CO32-)=3.0![]() 10-6mol/L,Ksp[Ce2(CO3)3]=c2(Ce3+)·c3(CO32-)=(2.0
10-6mol/L,Ksp[Ce2(CO3)3]=c2(Ce3+)·c3(CO32-)=(2.0![]() 10-6)2
10-6)2![]() (3.0
(3.0![]() 10-6)3=1.08
10-6)3=1.08![]() 10-28;当Ce3+沉淀完全时,c3(CO32-)=
10-28;当Ce3+沉淀完全时,c3(CO32-)=![]() =
=![]() =1.08
=1.08![]() 10-18,c(CO32-)=1.026
10-18,c(CO32-)=1.026![]() 10-6mol/L
10-6mol/L![]() 1.0
1.0![]() 10-6mol/L。
10-6mol/L。
(6)根据题意,“CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。”CO具有还原性,CeO2消除CO尾气时应供氧,反应的化学方程式为CeO2+2xCO=CeO2(1-x)+2xCO2。

 口算题天天练系列答案
口算题天天练系列答案【题目】如图是元素周期表的一部分:

(1)元素⑩原子结构示意图为__________.
(2)元素③④的第一电离能大小关系为_______(填化学用语,下同),原因是__________________。④-⑧中最高价氧化物对应水化物酸性最强的是_______.
(3)写出元素⑦的最高价氧化物与NaOH溶液反应的离子方程式_________。
(4)元素⑤ 与⑧ 元素相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性
B.两元素的电负性
C.单质分子中的键能
D.含氧酸的酸性
E.氢化物中X—H键的键长
F.两单质在自然界中的存在形式
(5)根据下列五种元素的第一至第四电离能数据(单位:KJ·mol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①T元素最可能是________(填“s”、“p”、“d”、“ds”等)区元素;
在周期表中,最可能处于同一主族的是_________.(填元素代号),
②下列离子的氧化性最弱的是______________。
A.S2+ B.R2+ C.U+ D.T3+