题目内容
【题目】现有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL该溶液进行如下实验:(已知:NH4++OH-![]() NH3↑+H2O)
NH3↑+H2O)
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到0.08mol气体;
(3)第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g。根据上述实验,回答以下问题。
(1)由第一份进行的实验推断该混合物是否一定含有Cl-?________(答是或否)
(2)由第二份进行的实验得知混合物中应含有_____(填离子符号),其物质的量浓度为______。
(3)由第三份进行的实验可知12.54g沉淀的成分为________。
(4)综合上述实验,你认为以下结论正确的是_________。
A.该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol
B.该混合液中一定有NH4+、CO32-、SO42-,可能含有K+、Cl-
C.该混合液中一定有NH4+、CO32-、SO42-,可能含有Mg2+、K+、Cl-
D.该混合液中一定有NH4+、SO42-,可能含有Mg2+、K+、Cl-
(5)我国政府为消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3+KI+H2SO4=K2SO4+I2+H2O
①配平该方程式,并且用单线桥法表示该方程式电子转移的方向和数目:________。
②该反应中氧化剂和还原剂的物质的量之比为_____________。
③如果反应中转移0.5mol电子,则生成I2的物质的量为_________。
【答案】否 NH4+ 0.8mol/L BaSO4、BaCO3 A 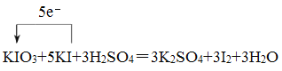 1:5 0.3mol
1:5 0.3mol
【解析】
第一份加入AgNO3溶液有沉淀产生,则一定含有Cl-、CO32-、SO42-中的一种;第二份加足量NaOH溶液加热后,收集到气体0.08mol,气体为氨气,则一定含NH4+;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,则沉淀为碳酸钡、硫酸钡,SO42-的物质的量为4.66g÷233g/mol=0.02mol,CO32-的物质的量为(12.54-4.66)g÷197g/mol=0.04mol,结合离子之间的反应及电荷守恒来解答。
第一份加入AgNO3溶液有沉淀产生,则一定含有Cl-、CO32-、SO42-中的一种;第二份加足量NaOH溶液加热后,收集到气体0.08mol,气体为氨气,则一定含NH4+;第三份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤干燥后,沉淀质量为4.66g,则一定含硫酸钡,SO42-的物质的量为4.66g÷233g/mol=0.02mol,CO32-的物质的量为(12.54-4.66)g÷197g/mol=0.04mol,含CO32-、SO42-,则一定不含Mg2+、Ba2+,阳离子电荷总量为0.08mol,CO32-、SO42-的电荷总量为0.02mol×2+0.04mol×2=0.12mol,由电荷守恒可知,一定含阳离子K+,综上所述,不能确定是否含有Cl-;则根据电荷守恒溶液中K+的物质的量≥0.12mol-0.08mol=0.04mol。
(1)根据以上分析可知由第一份进行的实验推断该混合物中不一定含有Cl-;
(2)根据以上分析可知由第二份进行的实验得知混合物中应含有NH4+,其物质的量浓度为0.08mol÷0.1L=0.8mol/L;
(3)根据以上分析可知由第三份进行的实验可知12.54g沉淀的成分为BaSO4、BaCO3;
(4)综合上述实验,该混合液中一定有K+、NH4+、CO32-、SO42-,可能含Cl-,且n(K)≥0.04mol,答案选A。
(5)①反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,可知(KIO3):n(KI)=1:5,结合质量生成配平方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O,用单线桥法表示该方程式电子转移的方向和数目为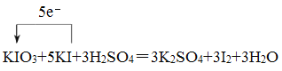 ;
;
②KIO3为氧化剂,KI为还原剂,由方程式可知氧化剂和还原剂的物质的量之比为1:5;
③在上述反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.5mol电子,则生成I2的物质的量为0.3moL。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案