题目内容
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA
B. 1L0.1mol·L-1的醋酸溶液中含有氢离子数目为0.1NA
C. 标准状况下,2.24LCCl4含碳原子数目为0.1NA
D. 将5.85 g NaCl固体溶解在100 mL水中,得到溶液中c(Na+)=1mol/L
【答案】A
【解析】
A、氧气和臭氧均由氧原子构成;
B、醋酸为弱电解质,不能完全电离;
C、标况下四氯化碳为液态;
D、溶液体积不为100 mL,无法计算。
A、氧气和臭氧均由氧原子构成,故3.2g氧气和臭氧混合物中含有的氧原子的物质的量为n=![]() =0.2mol,个数为0.2NA个,选项A正确;
=0.2mol,个数为0.2NA个,选项A正确;
B、醋酸为弱电解质,不能完全电离,故溶液中的氢离子的个数小于0.1NA个,选项B错误;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和含有的碳原子的个数,故C错误;
D、将5.85 g NaCl固体溶解在100 mL水中,得到溶液的体积不是0.1L,选项D错误。
故选A。

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】某兴趣小组用下图所示装置制备气体(酒精灯可以根据需要选择),对应说法正确的是
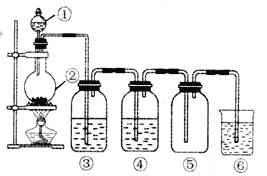
选项 | ①中药品 | ②中药品 | ③中药品 | ④中药品 | 制备气体 | ⑥中药品及作用 |
A | 浓盐酸 | MnO2 | 饱和食盐水 | 浓硫酸 | C12 | NaOH溶液,尾气吸收 |
B | 稀硝酸 | Cu | 烧碱溶液 | 浓硫酸 | NO | Na()H溶液,尾气吸收 |
C | 浓盐酸 | 大理石 | 饱和Na2CO3溶液 | 浓硫酸 | CO2 | 澄清石灰水,检验CO2 |
D | 浓盐酸 | Zn | 水 | 浓硫酸 | H2 | 可撤去 |
A. A B. B C. C D. D
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
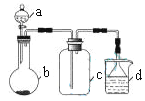
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |