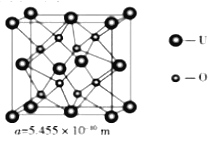
��Ŀ����
����Ŀ��ͨ�����·�Ӧ�ɻ��������Դ������(CH3OCH3)������˵������ȷ����
��C(s)+H2O(g)=CO(g)+H2(g) ��H1=akJ/mol
��CO(g)+H2O(g)=CO2(g)+H2(g) ��H2=bkJ/mol
��CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ��H3=ckJ/mol
��2CH3OH(g)=CH3OCH3(g)+H2O(g) ��H4=dkJ/mol
A. ��Ӧ�١���Ϊ��Ӧ���ṩԭ��������a>0
B. ��Ӧ��Ҳ��CO2��Դ�����õķ���֮һ
C. ��ӦCH3OH(g)=1/2CH3OCH3(g)+1/2H2O(g) ��H=d/2kJ/mol
D. ��Ӧ2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g)����H=-(2b+2c+d)kJ/mol
���𰸡�D
��������A����Ӧ�١�������H2��CO2��Ϊ��Ӧ���ṩԭ��������ӦC��s��+H2O��g��=CO��g��+H2��g��Ϊ���ȷ�Ӧ��a![]() 0��A����ȷ��B����Ӧ������CO2����CO2��Դ�����õķ���֮һ��B����ȷ��C����Ӧ���Ļ�ѧ��������Ϊԭ����
0��A����ȷ��B����Ӧ������CO2����CO2��Դ�����õķ���֮һ��B����ȷ��C����Ӧ���Ļ�ѧ��������Ϊԭ����![]() ����HҲ��Ϊԭ����
����HҲ��Ϊԭ����![]() ����ӦCH3OH��g��=1/2CH3OCH3��g��+1/2H2O��g����H=d/2kJ/mol��C����ȷ��D��Ӧ�ø�˹���ɣ�����
����ӦCH3OH��g��=1/2CH3OCH3��g��+1/2H2O��g����H=d/2kJ/mol��C����ȷ��D��Ӧ�ø�˹���ɣ�����![]() 2+��
2+��![]() 2+������2CO��g��+4H2��g��=CH3OCH3��g��+H2O��g����H=��2b+2c+d��kJ/mol��D�����ѡD��
2+������2CO��g��+4H2��g��=CH3OCH3��g��+H2O��g����H=��2b+2c+d��kJ/mol��D�����ѡD��

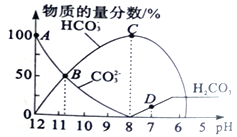
 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HClO |
|
|
����ƽ�ⳣ�� |
|
|
|
|
��1��������![]()
![]()
![]()
![]()
![]() ��Һ��pH�ɴ�С�Ĺ�ϵΪ______��
��Һ��pH�ɴ�С�Ĺ�ϵΪ______��
��2��Ũ�Ⱦ�Ϊ![]() ��
��![]() ��
��![]() �Ļ����Һ�У�
�Ļ����Һ�У� ![]() ��
��![]() ��
��![]() ��
��![]() Ũ�ȴӴ�С��˳��Ϊ______��
Ũ�ȴӴ�С��˳��Ϊ______��
��3������![]() ͨ�뵽������NaClO��Һ�з�����Ӧ�����ӷ���ʽ______��
ͨ�뵽������NaClO��Һ�з�����Ӧ�����ӷ���ʽ______��
��4�������£� ![]() ��HCOOH��Һ��
��HCOOH��Һ��![]() ��NaOH��Һ�������Ϻ���Һ������Ũ���ɴ�С��˳��Ϊ______��
��NaOH��Һ�������Ϻ���Һ������Ũ���ɴ�С��˳��Ϊ______��