题目内容
【题目】
铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4【UO2(CO3)3】等。回答下列问题:
(1) UF4用Mg或Ca还原可得金属铀。金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为__________________;基态钙原子核外电子排布式为_________________;熔点:MgO(2852℃)高于CaO(2614℃),其原因是_____________________________。
(2) ![]() 。NH4HF2中所含作用力有____________(填字母)。
。NH4HF2中所含作用力有____________(填字母)。
a. 氢键 b. 配位键 c. 共价键 d. 离子键 e. 金属键
(3)已知:![]() .
.
①NH4+ 的空间构型为__________________,与NH4+ 互为等电子体的分子或离子有________(写两种)
②CO32- 中碳原子杂化轨道类型为______________________。
③分解产物中属于非极性分子的是_____________________(填字母)。
a. NH3 b. CO2 c. N2 d. H2O
(4) UO2 的晶胞结构及晶胞参数如下图所示:
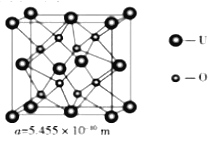
①晶胞中U的配位数为_________________。
②UO2 的密度为_________________g·cm-3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
【答案】 68% ![]() 或【Ar】4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高(答案合理即可) abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8
或【Ar】4s2 CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高(答案合理即可) abcd 正四面体 CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等 sp2 bc 8 ![]()
【解析】(1). 体心立方中含有U原子的个数为1+8×![]() =2,设U原子的半径为rcm,则晶胞中U原子的体积为:2×
=2,设U原子的半径为rcm,则晶胞中U原子的体积为:2×![]() ×π×r3,在体心立方中,体对角线上为三个U原子相切,则体对角线为4rcm,晶胞边长为
×π×r3,在体心立方中,体对角线上为三个U原子相切,则体对角线为4rcm,晶胞边长为![]() cm,晶胞体积为
cm,晶胞体积为![]() ,空间利用率为[(2×
,空间利用率为[(2×![]() ×π×r3)÷
×π×r3)÷![]() ]×100%=68%,钙是20号元素,基态钙原子核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2,MgO和CaO都是离子晶体,镁离子的半径小于钙离子半径,MgO的晶格能大于CaO,所以MgO晶体的熔点高,故答案为:68%;1s22s22p63s23p64s2或[Ar]4s2;CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高;
]×100%=68%,钙是20号元素,基态钙原子核外电子排布式为1s22s22p63s23p64s2或[Ar]4s2,MgO和CaO都是离子晶体,镁离子的半径小于钙离子半径,MgO的晶格能大于CaO,所以MgO晶体的熔点高,故答案为:68%;1s22s22p63s23p64s2或[Ar]4s2;CaO和MgO均为离子晶体,MgO的晶格能大于CaO,故MgO晶体的熔点高;
(2). NH4HF2中含有NH4+、H+和F-,该化合物是离子化合物,所以含有离子键,N原子与H原子之间存在共价键、配位键和氢键,故答案为:abcd;
(3). ①. NH4+中N原子的价层电子对数=4+![]() =4+0=4,N原子的杂化方式为sp3,没有孤电子对,所以NH4+的空间构型是正四面体形,根据等电子体原理,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4等,故答案为:正四面体;CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等;
=4+0=4,N原子的杂化方式为sp3,没有孤电子对,所以NH4+的空间构型是正四面体形,根据等电子体原理,与NH4+互为等电子体的分子或离子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4等,故答案为:正四面体;CH4、BH4-、BeH42-、AlH4-、SiH4及GeH4等;
②. CO32-中碳原子的价层电子对数=3+![]() =3,所以碳原子杂化轨道类型为sp2,故答案为:sp2;
=3,所以碳原子杂化轨道类型为sp2,故答案为:sp2;
③. 根据价层电子对互斥理论,NH3的分子构型为三角锥形,属于极性分子,CO2的分子构型为直线形,属于非极性分子,N2的分子构型为直线形,属于非极性分子,H2O的分子构型为V形,属于极性分子,故答案为:bc;
(4). ①. 由晶胞示意图可知,在UO2的晶胞中U原子位于顶点和面心,O原子位于体心,每个晶胞中有4个O原子与U原子距离最近,每个面为2个晶胞共有,则晶胞中U原子的配位数为8,故答案为:8;
②. 由晶胞示意图可知,在UO2的晶胞中U原子位于顶点和面心,O原子位于体心,则每个晶胞中U原子的个数为8×![]() +6×
+6×![]() =4,O原子的个数为,即每个晶胞中含有4个UO2,所以UO2的密度为:
=4,O原子的个数为,即每个晶胞中含有4个UO2,所以UO2的密度为:![]() ,故答案为:
,故答案为:![]() 。
。