题目内容
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
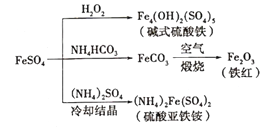
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
【答案】B
【解析】
A.碱式硫酸铁电离产生Fe3+,Fe3+能发生水解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附性,可用作净水剂,故A正确;
B.(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的小,所以FeSO4才能与(NH4)2SO4反应生成(NH4)2Fe(SO4)2,B错误;
C.KSCN溶液遇Fe2+溶液无现象,(NH4)2Fe(SO4)2若被氧化则生成Fe3+,KSCN溶液遇Fe3+溶液变红,C正确;
D.NH4HCO3不稳定,受热易分解,所以为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,D正确;
故合理选项是B。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:CH3OH(g)+CO(g) ![]() CH3COOH(g)ΔH<0。下列说法正确的是
CH3COOH(g)ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 600 | 1.0 | 1.0 | 0 | 0.80 |
II | 600 | 0.40 | 0.40 | 0.80 | |
III | 575 | 0 | 0 | 1.0 | |
A. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
B. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
C. 达平衡时,容器I与容器II中的总压强之比为5:6
D. 达平衡时,容器Ⅲ中c(CH3COOH)小于0.80mol/L
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定中和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,则中和热△H=___kJ/mol。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:(用离子方程式表示)___________。
(2)达到滴定终点时的颜色变化为___________ 。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的___________读数为mL。

(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验序号 | ① | ② | ③ |
消耗KMnO4溶液体积/mL | 26.53 | 24.02 | 23.98 |
从上表可以看出,实验①中记录消耗KMnO4溶液的体积明显多于②③,其原因可能是 ______________________。
A.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
B.①滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,②③均用标准液润洗
C.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
D.①滴定用的锥形瓶用待测液润洗过,②③未润洗
(5)H2C2O4的物质的量浓度=______________mol/L。

