题目内容
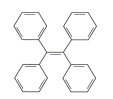
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的—半。下列叙述错误的是

A. Z的氧化物的水化物是强酸
B. 元素非金属性的顺序为X<Y<Z
C. W与Z两种元素形成的化合物中只含有离子键
D. 该新化合物中Y满足8电子稳定结构
【答案】A
【解析】
W、X、Y、Z为同一短周期元素,根据图知,X能形成4个共价键、Z能形成1个共价键,则X位于第IVA族、Z位于第VIIA族,且Z核外最外层电子数是X核外电子数的一半,Z最外层7个电子,则X原子核外有14个电子,X为Si元素,Z为Cl元素,该阴离子中Cl元素为-1价、X元素为+4价,根据化合价的代数和为-1价可知,Y为-3价,所以Y为P元素,根据阳离子所带电荷知,W为Na元素,据此解答。
根据分析可知:W、X、Y、Z分别是Na、Si、P、Cl元素。
A.Y为P元素,Y的最高价氧化物的水合物是H3PO4为中强酸,属于弱酸,A错误;
B.同一周期元素非金属性随着原子序数增大而增强,则非金属性Cl>P>Si,即X<Y<Z,B正确;
C.Na、Cl生成的化合物为NaCl,NaCl为离子化合物,只含离子键,C正确;
D.Y为P元素,其最外层有5个电子,P原子形成2个共价键且该阴离子得到W原子一个电子,所以P原子达到8电子结构,D正确;
故合理选项是A。

练习册系列答案
相关题目