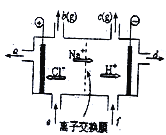
题目内容
【题目】500oC下,在2L体积固定的密闭容器中发生反应:2A(g)![]() 2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
2B(g)+C(g)若开始时只充入2molA气体,达平衡时,混合气体的总物质的量为2.4mol。(作答此题时,要求写出计算过程)
(1)计算500oC时该反应的化学平衡常数?
(2)平衡时A的转化率是多少?
(3)设温度不变,反应前容器内压强为p0,则反应达平衡时,容器内压强是多少?(用p0表示)
【答案】(1)0.089(2)x100%(3)1.2p0
【解析】试题分析:解此类计算题,要先计算出题目所给出的反应物的浓度,按照反应进行的始末,列出方程,列出等式。
解:(1)2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
起始:1mol/L 0 0
变化:x x 1/2x
平衡:1—x x 1/2x
依题意有1—x+x+1/2x=1.2mol/L解得x=0.4mol/L化学平衡常数
![]()
![]()
(2)A的转化率w%=![]() =x100%
=x100%
![]()
![]()

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案
相关题目
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)![]() 2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
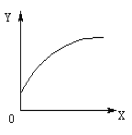
X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |