题目内容
【题目】I..已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:
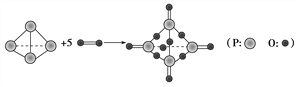
试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量为________kJ
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
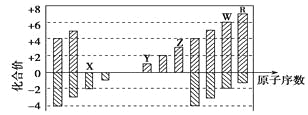
II.将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶
液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:

(1)该实验表明此反应_______(填“吸收”或“释放”)能量, 通过图示分析可以得出:做该实
验时,环境温度________(填“高于”、“低于”或“等于”)22 ℃。
(2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
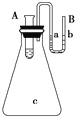
III. 如图所示在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体
②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_____(填序号)
【答案】 298.2 释放 低于 3.0 mol·L-1 ③
【解析】I.各化学键键能为P-P198kJmol-1、P-O360kJmol-1、P=O585kJmol-1、O=O498kJmol-1;反应热△H=反应物总键能-生成物总键能,
所以反应P4+5O2=P4O10的反应热△H=6×198kJmol-1+5×498kJmol-1-(4×585Jmol-1+12×360kJmol-1)=298.2kJmol-1;
II.(1)根据实验结果图所示,5mLHCl溶液和45mLNaOH溶液反应放热后的温度已经是22℃,又HCl溶液和NaOH溶液反应是中和反应,为放热反应,释放能量,可以知道该实验开始时温度一定是低于22℃;
(2)恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50mL,消耗的氢氧化钠溶液的体积为20mL,所以V1/V2=3/2;设恰好反应时氢氧化钠溶液中溶质的物质的量为n,
HCl+NaOH═NaCl+H2O
1 1
2.0molL-1×0.03L n
则n=2.0molL-1×0.03L=0.06mol,
所以浓度c=![]() =3mol/L;
=3mol/L;
III. a端高说明锥形瓶内气体压强降低,温度降低,则试管中的过程是吸热过程,而硝酸铵溶于水为吸热过程,故答案为③。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案