题目内容
【题目】25℃时,向20mL0.1molL-1盐酸溶液中逐滴加入等浓度的氨水溶液,溶液中pH与pOH(pOH=一lgc(OH-))的变化关系如图所示。下列说法正确的是
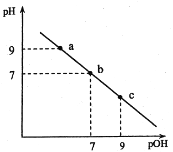
A.b点消耗氨水的体积为20mL
B.PH>7时,溶液中都一定有:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.a点和c点所示溶液中水所电离出的c(OH-)分别为10-9molL-1和10-5molL-1
D.ab段所示溶液中相关离子浓度关系可能为:c(NH4+)>c(Cl-)>C(NH3·H2O)
【答案】D
【解析】
试题分析:A、如果b点消耗氨水的体积为20mL,则溶质为NH4Cl,溶液显酸性,故错误;B、pH>7说明溶液显碱性,溶质为NH4Cl和NH3·H2O,离子浓度是c(NH4+)>c(OH-)>c(Cl-)>c(H+),故错误;C、a点溶液显碱性,水电离出c(H+)=10-9mol·L-1,b点溶液显酸性,溶质可能为NH4Cl和HCl,水电离出c(OH-)=10-9mol·L-1,故错误;D、ab段溶液显碱性,离子浓度可能是:c(NH4+)>c(Cl-)>C(NH3·H2O),故正确。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】I..已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:

试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量为________kJ
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
II.将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶
液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
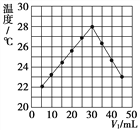
(1)该实验表明此反应_______(填“吸收”或“释放”)能量, 通过图示分析可以得出:做该实
验时,环境温度________(填“高于”、“低于”或“等于”)22 ℃。
(2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
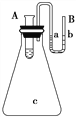
III. 如图所示在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体
②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_____(填序号)