题目内容
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
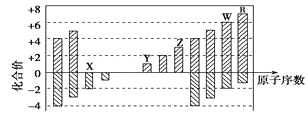
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R<W
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
【答案】D
【解析】试题分析:根据短周期元素原子序数与化合价的关系可知,X的主要化合价是-2价,因此X是氧元素。Y的主要化合价是+1价,且原子序数大于氧元素的原子序数,则Y是Na元素。以此类推Z是Al元素、W是S元素、R是氯元素。A、同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以原子半径:Y>Z>X,A不正确;B、同周期自左向右非金属性逐渐减弱,氢化物的稳定性逐渐减弱,所以气态氢化物的稳定性:R>W,B不正确;C、三氧化硫与水反应生成硫酸,硫酸是由共价键形成的共价化合物,C不正确;D、由于氢氧化铝是两性氢氧化物,能溶解在氢氧化钠溶液中生成偏铝酸钠和水,D正确,答案选D。

【题目】I..已知拆开或形成1 mol化学键所吸收或放出的能量叫做该化学键的键能,单位kJ·mol-1。白磷在氧气中燃烧的化学方程式可用结构式表示为如图所示:

试根据下表中的化学键键能计算0.1molP4(白磷)在氧气中充分燃烧放出能量为________kJ
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | 198 | 360 | 498 | 585 |
II.将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶
液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。请按要求填空:
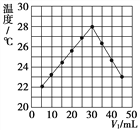
(1)该实验表明此反应_______(填“吸收”或“释放”)能量, 通过图示分析可以得出:做该实
验时,环境温度________(填“高于”、“低于”或“等于”)22 ℃。
(2)根据图示计算该NaOH溶液的浓度约是________mol·L-1。
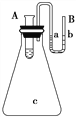
III. 如图所示在锥形瓶放置有装有水的小试管,往小试管中分别加入下列物质时:①烧碱固体
②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是_____(填序号)
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
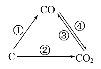
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g)ΔH1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)===CO(g)+H2(g)ΔH2>0;②
再燃烧水煤气:2CO(g)+O2(g)===2CO2(g)ΔH3<0,③
2H2(g)+O2(g)===2H2O(g)ΔH4<0。④
则途径Ⅰ放出的热量________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正____v逆(填“>”“<”或“=”)。
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
则反应N2(g)+3F2(g)═2NF3(g)的ΔH=
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2D.△H3=△H1﹣△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如6Ag(s)+O3(g)=3Ag2O(s)ΔH=-235.8kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2kJ·mol-1,
则O3转化为O2的热化学方程式为。

