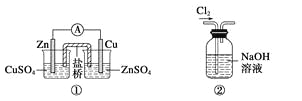
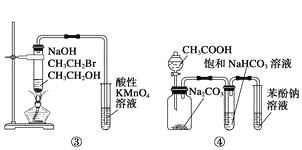
题目内容
【题目】通过以下反应均可获取H2.下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) △H1=+571.6kJmol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) △H2=+131.3kJmol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
CO(g)+3H2(g) △H3=+206.1kJmol﹣1.
A. 反应CH4(g)= C(s)+2 H2(g)的△H=+74.8kJmol﹣1 。
B. 电解水也可制取氢气和氧气,而且比方法①更方便,更节能。
C. 反应②每生成2g氢气,要吸收131.3kJ的热量,所以该反应没有应用价值。
D. 反应③中,若将各1mol的甲烷与水蒸气混合,要吸收206.1kJ的热量。
【答案】A
【解析】
A项,根据盖斯定律,③-②得CH4(g)= C(s)+2H2(g)的△H=+74.8kJmol﹣1,故A项正确;
B项,电解水分解需要在通电条件下进行反应,因此需要消耗电能,而反应①中光能转化为化学能,故B项错误;
C项,反应②生成的氢气和一氧化碳都具有可燃性和还原性,主要用途是用作燃料和冶炼金属,故C项错误;
D项,反应③为可逆反应,反应不能进行到底,所以1mol的甲烷与水蒸气混合,吸收的热量要小于206.1kJ,故D错误。
综上所述,本题正确答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】甲、乙同学用0.10mol/L H2C2O4草酸溶液、0.01mol/L KMnO4溶液、0.01mol/L H2SO4溶液、一定量的蒸馏水等试剂,进行探究实验,通过测定溶液褪色所需时间来探究浓度、温度对反应速率的影响。
(1)已知酸性KMnO4与H2C2O4反应后Mn元素以Mn2+形式存在溶液中,C元素转化为CO2气体逸出,请写出该反应的化学方程式____________。
(2)为探究反应物浓度、温度对化学反应速率的影响。甲同学设计的实验方案如下表:
实验序号 | 温度/℃ | 体积V/ mL | |||
H2C2O4溶液 | 水 | KMnO4溶液 | H2SO4溶液 | ||
1 | 25 | 10.0 | 0.0 | 4.0 | 2.0 |
2 | 25 | 8.0 | a | 4.0 | 2.0 |
3 | 50 | b | 0.0 | 4.0 | 2.0 |
①若以实验1为对照组,为了达到实验探究目的则a=____________,b=____________。
②若实验1测得溶液褪色所需时间为5s,则用高锰酸钾表示的反应速率为______________________。
(3)乙同学部分实验设计方案如下表:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
mol/L | mL | mol/L | mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.10 | 2.0 | 0.02 | 4.0 | 25 |
…… | |||||
该同学想通过实验①和②探究反应物浓度对化学反应速率的影响,请你对该方案的合理性进行评价,并说明理由__________________________。