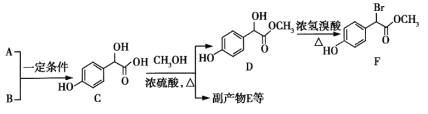
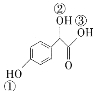
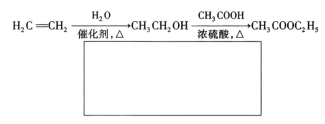
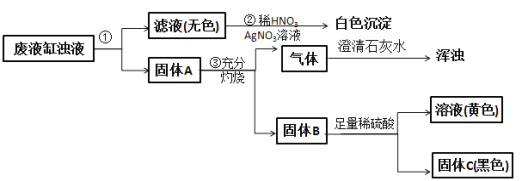
题目内容
【题目】下列有关热化学方程式及其叙述正确的是( )
A.氢气的燃烧热为285.5 kJmol-1,则水电解的热化学方程式为:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g) ![]() H=+285.8kJmol-1
H=+285.8kJmol-1
B.1mol甲烷完全燃烧生成CO2 (g)和H2O(l)时放出890kJ热量,它的热化学方程式为 1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1
H=-445kJmol-1
C.已知2C(s)+O2(g) ![]() 2CO(g)
2CO(g) ![]() H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
H=-221kJmol-1,则C的燃烧热为110.5 kJmol-1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq) = H2O(l) ![]() H=-57.3kJmol-1
H=-57.3kJmol-1
【答案】B
【解析】
A. 氢气燃烧热是放热反应,焓变为负值,水电解过程是吸热反应,电解2mol水要消耗的能量为571.0 kJ,A项错误;
B. 1mol CH4完全燃烧生成CO2和H2O(l)时放出890kJ热量,1/2mol甲烷完全燃烧生成二氧化碳和液态水放热445kJ,热化学方程式为:1/2CH4(g)+O2(g) ![]() 1/2CO2(g)+H2O(l)
1/2CO2(g)+H2O(l) ![]() H=-445kJmol-1,B项正确;
H=-445kJmol-1,B项正确;
C. 选项中反应生成的一氧化碳不是稳定氧化物,该反应热不是燃烧热,C项错误;
D. HF是弱酸,存在电离平衡,电离过程是吸热过程,热化学方程式中不能拆成离子,且1mol NaOH溶液与HF溶液反应放热小于57.3kJ,D项错误;
答案选B。

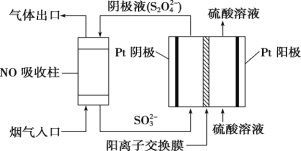
【题目】高铁酸钾(K2FeO4)是一新型高效无毒的多功能水处理剂。资料:K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
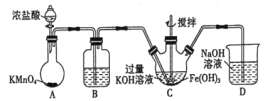
①写出A中发生反应的化学方程式______。
②除杂装置B中的试剂为____。
③C为制备K2FeO4装置,KOH溶液过量的原因是____。
④D为尾气处理装置,发生反应的离子方程式为____。
(2)探究K2FeO4的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl而产生Cl2设计以下方案:
方案Ⅰ | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生 |
①由方案Ⅰ中溶液变红可知a中含有____。该离子的产生__(填“能”或“不能”)判断一定是由K2FeO4被Cl还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是____,方案Ⅱ得出氧化性:Cl2 ___FeO42(填“![]() ”或“
”或“![]() ”)。
”)。