题目内容
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
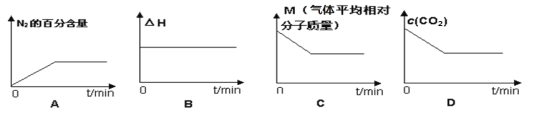
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
【答案】K=K2/K1 0.0125molL-1min-1 c(N2)c(CO2)/c(NO)2 0.5625 > 60% 0.3mol·L-1 A
【解析】
(1)根据三个反应的平衡常数表达式可判断平衡常数之间的关系;
(2)①根据数据,计算0~40 min内用NO的浓度变化表示的平均反应速率;
②依据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;
N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;
列出三行式,求该反应的平衡常数为;
③根据数据,在400℃时,甲丙容器,丙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度比甲的一半还要大,说明该反应为放热反应。再比较甲和乙,开始充入量相同,乙容器达到平衡时间短,反应快,且平衡时NO含量乙比甲多,说明温度比甲容器的高,升温平衡向逆反应方向移动,所以乙容器的反应温度T>400 ℃,
④由反应式2NO(g)+ C(s)![]() N2(g) +CO2(g)可知,
N2(g) +CO2(g)可知,
该反应为气体分子数不变的反应,改变压强不能使平衡发生移动,甲丙两容器建立等温等容条件下的等效平衡,NO的转化率和甲容器平衡时转化率相同;平衡时CO2的浓度为甲容器的一半。
⑤可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,以此分析。
(1)反应C(s)+CO2(g) ![]() 2CO(g)中K1=
2CO(g)中K1=![]() ,
,
反应C(s)+H2O(g) ![]() CO(g)+H2(g)中K2=
CO(g)+H2(g)中K2=![]() ,
,
反应CO(g)+H2O(g)![]() H2(g)+CO2(g)中K=
H2(g)+CO2(g)中K=![]() ,所以K= K=K2/K1,
,所以K= K=K2/K1,
故答案为:K=K2/K1;
(2)①根据数据,甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=![]() =0.0125molL-1min-1;
=0.0125molL-1min-1;
故答案为:0.0125molL-1min-1。
②依据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;400℃,甲容器120min时达到平衡,
N2(g) + CO2(g),平衡常数表达式为c(N2)c(CO2)/c(NO)2;400℃,甲容器120min时达到平衡,
2NO(g)+ C(s)![]() N2(g) + CO2(g)
N2(g) + CO2(g)
起始量(mol) 2.00 0 0
转化量(mol) 1.20 0.60 0.60
平衡量(mol) 0.80 0.60 0.60
则该反应的平衡常数为![]() =0.5625;
=0.5625;
故答案为:0.5625。
③根据数据,在400℃时,甲丙容器,丙的充入量为甲的一半,随着反应的进行,在各个时间段内NO的浓度比甲的一半还要大,说明该反应为放热反应。再比较甲和乙,开始充入量相同,乙容器达到平衡时间短,反应快,且平衡时NO含量乙比甲多,说明温度比甲容器的高,升温平衡向逆反应方向移动,所以乙容器的反应温度T>400 ℃,
故答案为:>。
④由反应式2NO(g)+ C(s)![]() N2(g) +CO2(g)可知,
N2(g) +CO2(g)可知,
该反应为气体分子数不变的反应,改变压强不能使平衡发生移动,甲丙两容器建立等温等容条件下的等效平衡,NO的转化率和甲容器平衡时转化率相同,为![]() 100%=60%;平衡时CO2的浓度为甲容器的一半,为
100%=60%;平衡时CO2的浓度为甲容器的一半,为![]() =0.3mol/L。
=0.3mol/L。
故答案为:60% ;0.3mol·L-1。
⑤可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的物理量不变,
A.N2的百分含量不变,说明达到平衡状态,故A选;
B.焓变对于确定的反应是恒定量,不能作为达到平衡的标志,故B不选;
C. 根据反应式2NO(g)+ C(s)![]() N2(g) + CO2(g),平均摩尔质量M=
N2(g) + CO2(g),平均摩尔质量M=![]() ,气体总物质的量不变,气体质量增加,所以气体平均摩尔质量应增大。故C不选;
,气体总物质的量不变,气体质量增加,所以气体平均摩尔质量应增大。故C不选;
D.CO2的浓度开始应为0,后来增加,故图像不正确,故D不选。
故答案为:A。

 阅读快车系列答案
阅读快车系列答案【题目】氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________。
2NH3。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10 min内,CO的物质的量减少的原因可能是________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2 L的恒容密闭容器中同时充入0.2 mol CH4、0.6 mol H2O、a mol CO和0.5 mol H2,当a=0.2时,上述反应向________(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为________(已知:0.253=0.0156)
【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.所配的标准NaOH溶液物质的量浓度偏大
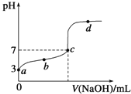
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |