题目内容
3.由于丁醇和醋酸的沸点相差很小,无法在蒸馏时顺利地将它们分离开来,因此在蒸馏丁醇和醋酸混合物时,一般先加入生石灰,把丁醇蒸馏出来后,再加入浓硫酸蒸馏得醋酸.分析 醋酸为酸,能与碱性氧化物反应,利用反应物物质沸点差异进行蒸馏分离出丁醇,然后利用强酸制取弱酸的原理蒸馏得出乙酸.
解答 解:加入生石灰,生石灰与醋酸反应(生成醋酸钙),而丁醇与生石灰不反应,故蒸馏时只能蒸出丁醇;然后再加入浓硫酸蒸馏生成醋酸,利用了强酸制弱酸的原理,且浓硫酸为高沸点酸,不易挥发,这样再次蒸馏时,醋酸就被蒸出,故答案为:生石灰;浓硫酸.
点评 本题主要考查的是有机物的分离,涉及到知识点:酸碱反应原理、蒸馏、强酸制取弱酸原理,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
13.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,Y能分别与X、Z形成原子个数比为1:3的化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | W的氯化物水溶液中滴加过量NaZ饱和溶液,可生成W的配合物用于冶金工业 | |
| C. | 由X、Y、Z组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | 已知YX3沸点远高于YZ3,则Y-X键的键能高于Y-Z键 |
14.有机物命名正确的是( )
| A. |  1,3,4-三甲苯 | B. |  2-甲基-1-丙醇 | C. |  2-甲基-2-氯丙烷 | D. | 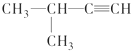 2-甲基-3-丁炔 |
11.下列物质在指定条件下电离方程式正确的是( )
| A. | Na2CO3溶于水 Na2CO3═Na22++CO32- | |
| B. | Al(OH)3酸式电离 Al(OH)3═H++AlO2-+H2O | |
| C. | NaHS溶于水HS-的电离 HS-+H2O?H2S+OH- | |
| D. | NaHCO3在水溶液中电离 NaHCO3═Na++HCO3- |
18.已知I2易溶于有机溶剂中,现欲从碘水中萃取出I2,下列溶剂不能作为萃取剂的是( )
| A. | 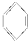 | B. | CCl4 | C. | 酒精 | D. | 氯仿 |
8.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为( )
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
15.分子式C8H8O2的有机物,含有一个苯环,且能发生水解反应,则该有机物苯环上的一溴代物有( )
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 25种 |
12.某甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸、和水等,某同学为了检验产品中的苯甲酸和硫酸,做了如下实验.(已知H2SO3:K1=1.3×10-2 K2=6.3×10-8,苯甲酸:Ka=6.46×10-5,碳酸;K1=4.30×10-7 K2=5.61×10-11)限选试剂:0.1 mol•L-1BaCl2溶液,0.1 mol•L-1Ba(OH)2溶液,1.0 mol•L-1Na2CO3溶液,1.0mol•L-1NaHCO3溶液,1 mol•L-1HCl溶液,1 mol•L-1Na2SO3溶液,1 mol•L-1NaHSO3溶液.
| 实验操作 | 实验现象及结论 |
| ①取粗产品于试管中,加入1.0 mol•L-1Na2CO3溶液,酯溶解度减小振荡分层,用分液漏斗分液,得到水层加入0.1 mol•L-1BaCl2溶液 | 白色沉淀生成,说明含有硫酸 |
| ②取①反应后的溶液于试管中,加入1 mol•L-1HCl溶液 | 出现白色晶体,证明含有苯甲酸 |
17.下列微粒半径之比大于1的是( )
| A. | $\frac{{r}_{(p)}}{{r}_{(Si)}}$ | B. | $\frac{{r}_{(Be)}}{{r}_{(Mg)}}$ | C. | $\frac{{r}_{({K}^{+})}}{{r}_{(N{a}^{+})}}$ | D. | $\frac{{r}_{(cl)}}{{r}_{(c{l}^{-})}}$ |