题目内容
2.设NA为阿伏伽德罗常数的值.下列叙述正确的是( )| A. | 2.4g镁变为镁离子失去的电子数为0.1NA | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g | |
| C. | 标准状况下,2.24L四氯化碳含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,当生成0.2molO2时,转移电子的数目为0.4NA |
分析 A.一个镁原子失去2e-变为镁离子;
B.电解精炼铜时,阳极上是粗铜,粗铜上有其他金属杂质;
C.气体摩尔体积使用对象为气体;
D.Na2O2与H2O的反应是歧化反应;
解答 解:A.2.4g镁物质的量为0.1mol,变为镁离子失去的电子数为0.2NA,故A错误;
B.电解精炼铜时,阳极上是粗铜,粗铜上有其他比铜活泼的金属杂质也会放电,故阴极得到电子数为2NA时,阳极减少的质量不一定是64g,故B错误;
C.标况下,四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.Na2O2与H2O的反应是歧化反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,注意过氧化钠与水反应中,氧化剂、还原剂都是过氧化钠,题目难度不大.

练习册系列答案
相关题目
12.下列装置能达到相应实验目的是( )
| A. | 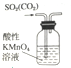 装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. | 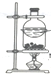 装置,分离NH4Cl和Ca(OH)2固体 | |
| D. | 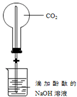 装置,做喷泉实验 |
13.2011年3月,双汇“瘦肉精”事件爆发,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”.“瘦肉精”的结构可表示为: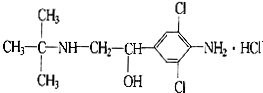 下列关于“瘦肉精”的说法中正确的是( )
下列关于“瘦肉精”的说法中正确的是( )
 下列关于“瘦肉精”的说法中正确的是( )
下列关于“瘦肉精”的说法中正确的是( )| A. | 摩尔质量为305.5 | |
| B. | 属于芳香族化合物,也是高分子化合物 | |
| C. | 1mol该有机物在一定条件下可与3 mol氢气发生加成反应 | |
| D. | 向此有机物中加入硝酸酸化的硝酸银溶液会产生淡黄色的沉淀 |
10.下列物质的水溶液中不存在溶质分子的是( )
| A. | H2S | B. | HF | C. | HNO3 | D. | NH3•H2O |
17.下列说法不正确的是( )
| A. | 能量的释放或吸收是以发生变化的物质为基础的,二者密不可分,但以物质为主,如果物质没有变化,就不能引发能量的变化 | |
| B. | 氢能的优点是燃烧热值高,资源丰富,无毒无污染,且便于储存和运输,因此很可能成为未来的主要能源 | |
| C. | 对于在给定条件下反应物之间能够同时发生多个反应的情况,理想的催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| D. | 离子反应的速率决定于溶液中离子的浓度和离子的扩散速率,受温度影响不大,是一类不需要活化能来引发的反应,所以反应速率很高 |
7.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法不正确的是( )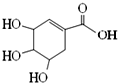

| A. | 分子式为C7H10O5 | |
| B. | 分子中含有3种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出氢离子 |
14.下列说法中不正确的是( )
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
①将BaSO4放入水中不能导电,所以BaSO4是非电解质;
②氨溶于水得到的溶液能导电,所以氨水是电解质;
③固态的共价化合物不导电,熔融态的共价化合物可以导电;
④熔融的NaCl在电流作用下电离成Na+和Cl-;
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强;
⑥强电解质都是离子化合物,弱电解质都是共价化合物,
⑦强电解质的水溶液中不存在溶质分子.
| A. | ①②③⑥ | B. | ①③⑤⑥⑦ | C. | ①②③④⑤⑥ | D. | 全部 |
12.下列物质的转化,在给定条件下均能通过一步反应实现的是( )
| A | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
| B | NaCl(饱和)$→_{②CO_{2}}^{①NH_{3}}$NaHCO3$\stackrel{△}{→}$Na2CO3 |
| C | Fe$→_{点燃}^{少量Cl_{2}}$FeCl2$\stackrel{Cl_{2}}{→}$FeCl3 |
| D | FeS2$→_{煅烧}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 |
| A. | A | B. | B | C. | C | D. | D |