题目内容
【题目】Ⅰ.某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO32-)=______mol·L1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_________________;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是___________________________;
(4)写出③中固体加入足量盐酸洗涤的离子方程式________________________________。
Ⅱ.四种物质有如下相互转化关系:
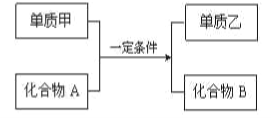
(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为____________________;
(6)若甲是活泼金属,化合物B是强碱,则该反应的离子方程式为____________;
(7)若乙是黑色固体,化合物B是优质的耐高温材料。则该反应的化学方程式为____________________;
(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料。则该反应的化学方程式为____________________。
【答案】 1 ≥2 molL1 取少量原溶液置于试管中,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子 BaCO3+2H+=Ba2++H2O+CO2↑ 2Al+Fe2O3![]() 2Fe+Al2O3 2Na+2H2O=2Na++2OH-+H2↑(或2K+2H2O=2K++2OH-+H2↑) 2Mg+CO2
2Fe+Al2O3 2Na+2H2O=2Na++2OH-+H2↑(或2K+2H2O=2K++2OH-+H2↑) 2Mg+CO2![]() 2MgO+C SiO2+2C
2MgO+C SiO2+2C![]() Si+2CO↑
Si+2CO↑
【解析】无色溶液中不存在Fe3+,①第一份加入AgNO3溶液有沉淀产生,则Cl-、CO32-和SO42-至少含有一种;②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下),气体是氨气,物质的量是0.02mol,因此含有0.02mol NH4+;③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g,所以一定存在CO32-和SO42-,因此不能存在Ca2+。其中硫酸根的物质的量是2.33g÷233g/mol=0.01mol,碳酸钡的质量是4.30g-2.33g=1.97g,则碳酸根离子的物质的量是1.97g÷197g/mol=0.01mol。
(1)c(CO32-)=0.01mol÷0.01L=1.0 mol·L1;(2)根据电荷守恒可知阴离子所带电荷数大于阳离子所带电荷数,所以该溶液中一定存在K+。铵根的浓度是2.0mol/L,硫酸根的浓度是1.0mol/L,由于氯离子不能确定,则K+浓度范围是≥2 molL1;(3)根据以上实验可知氯离子可能存在,检验该离子是否存在的方法是取少量原溶液置于试管中,加足量硝酸钡溶液过滤,取滤液加足量稀硝酸和硝酸银溶液,若有沉淀证明存在氯离子,否则无氯离子;(4)③中固体加入足量盐酸洗涤时碳酸钡溶解,反应的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑。(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应是金属铝与氧化铁的铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3;(6)若甲是活泼金属,化合物B是强碱,则该反应是钠或与水的反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑或2K+2H2O=2K++2OH-+H2↑;(7)若乙是黑色固体,化合物B是优质的耐高温材料,则该反应是镁在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2
2Fe+Al2O3;(6)若甲是活泼金属,化合物B是强碱,则该反应是钠或与水的反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑或2K+2H2O=2K++2OH-+H2↑;(7)若乙是黑色固体,化合物B是优质的耐高温材料,则该反应是镁在二氧化碳中燃烧,反应的化学方程式为2Mg+CO2![]() 2MgO+C;(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料,则该反应是碳与二氧化硅的反应,反应的化学方程式为SiO2+2C
2MgO+C;(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料,则该反应是碳与二氧化硅的反应,反应的化学方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案